
 化学兴趣小组在老师指导下,对“蜡烛燃烧的产物”进行探究.
化学兴趣小组在老师指导下,对“蜡烛燃烧的产物”进行探究.分析 【实验探究1】
水蒸气冷凝后变成水珠;
氢氧化钙和二氧化碳反应生成碳酸钙和水;
【反思质疑】
饱和氢氧化钙溶液温度升高时会析出固体;
【交流讨论】
石蜡不完全燃烧能生成炭黑等物质;
【实验探究3】
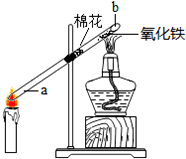
棉花可以阻止炭黑和氧化铁接触;
氧化铁在高温条件下能和一氧化碳反应生成铁和二氧化碳;
铁在高温条件下能够被空气中的氧气氧化;
增大可燃物与氧气的接触面积,增大氧气的浓度,都能够促进可燃物燃烧.
解答 解:【实验探究1】
(1)用干冷的小烧杯罩在蜡烛火焰上,观察到烧杯内壁出现水珠,证明有水生成.
(2)二氧化碳和石灰水反应的化学方程式为:Ca(OH)2+CO2═CaCO3↓+H2O.
故填:烧杯内壁出现水珠;Ca(OH)2+CO2═CaCO3↓+H2O.
【反思质疑】
石灰水变浑浊不一定是生成了碳酸钙,还可能是饱和石灰水受热后溶解度减小,析出了氢氧化钙.
故填:析出了氢氧化钙.
【交流讨论】
“实验探究2”中,集气瓶内壁上的黑色粉末可能是石蜡不完全燃烧生成的炭黑.
故填:炭黑.
【实验探究3】
(2)为了阻止炭黑和氧化铁反应,在玻璃管中部,提前放入了一团棉花;
故填:炭黑和氧化铁反应;
(3)一会儿,红棕色氧化铁逐渐变成黑色,证明蜡烛不完全燃烧确实有一氧化碳生成;b端发生反应的化学方程式为:Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2;
故填:红棕;Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2;
(4)为防止玻璃管b端生成的黑色物质又被氧化,接下来需要先熄灭酒精灯,一会儿后再熄灭蜡烛.
故填:先熄灭酒精灯,一会儿后再熄灭蜡烛.
【拓展应用】
为使其完全燃烧,可以采取的方法是:增大可燃物与氧气的接触面积,增大氧气的浓度.
故填:增大燃料和氧气的接触面积.
点评 合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.


科目:初中化学 来源: 题型:解答题
 溶解度是指在一定温度下,某固态物质在100g溶剂中达到饱和状态时所溶解的溶质的质量.
溶解度是指在一定温度下,某固态物质在100g溶剂中达到饱和状态时所溶解的溶质的质量.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 纯净物一定是化合物 | |
| B. | 混合物中元素不一定都是化合态 | |
| C. | 某物质不是化合物就是单质 | |
| D. | 某物质中只含有一种元素,它一定是纯净物 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
| 实验操作 | 实验现象 | 结论 |
| 将澄清的石灰水分别滴入盛有教室内的空气和操场上的空气的集气瓶中 | 教室内的空气瓶中石灰水变浑浊;操场上的空气瓶中石灰水无明显变化. | 教室内的空气中二氧化碳含量比操场上的空气中高. |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 实验步骤 | 实验现象 | 实验结论 |
| (1)取少量滤液于试管中,向其滴加2滴~3滴无色酚酞试液,振荡 | 溶液由无色变为红色 | 该瓶中白色粉末一定不是碳酸钙和氯化钠 |
| (2)另取少量滤液于试管中,滴加过量氯化钙溶液,振荡,静置 | 产生白色沉淀 | 该瓶中白色粉末一定有碳酸钠,涉及的化学方程式为Na2CO3+CaCl2=2NaCl+CaCO3↓ |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 实验步骤 | 实验现象 | 解释或结论 |
| ①取适量烧碱样品置于试管中,加水溶解,并用手触摸试管外壁. | 试管外壁发热 | 原因是氢氧化钠溶于水放热 |
| ②向①所得的溶液中逐滴加入过量稀硝酸 | 一开始无明显现象,一段时间后产生能使澄清石灰水变浑浊的气体. | 样品中含有的 杂质是碳酸钠. |
| ③向②所得的溶液中滴加几滴硝酸银溶液 | 产生白色沉淀 | 样品中还含有的杂 质是氯化钠 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com