
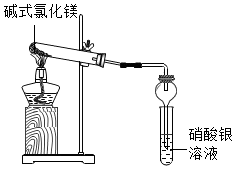
 碱式氯化镁[Mg(OH)Cl]受热能分解,它分解后产物是什么?小科进行了探究.
碱式氯化镁[Mg(OH)Cl]受热能分解,它分解后产物是什么?小科进行了探究.分析 【实验一】根据参加反应的物质及反应现象分析;
【实验二】根据镁能与稀盐酸反应生成氢气分析;
【实验三】根据氯离子与银离子结合生成白色沉淀分析;
【结论】根据反应物、生成物及质量守恒定律分析;
解答 解:【实验一】取少量的Mg(OH)Cl放入大试管中进行加热,加热过程中观察到足量硝酸银溶液中有白色沉淀产生,一段时间后,沉淀不再产生,大试管口也没有液滴形成,管内有固体剩余,无其他现象.由此可推知Mg(OH)Cl分解后产物中有氯化氢气体,氯离子与银离子结合生成了氯化银白色沉淀;故填:HCl;
【实验二】在Mg(OH)Cl分解后可能有的产物中只有Mg、MgCl2、MgO三种固体,Mg会与稀盐酸反应生成氢气,本实验中在剩余固体中加入足量稀盐酸,没有气泡产生,由此推知Mg(OH)Cl分解后产物中没有Mg;故填:Mg;
【实验三】若剩余固体中含有氯化镁,则加入AgNO3溶液后会有沉淀产生,加入足量稀硝酸,固体全部溶解,再滴入AgNO3溶液,无沉淀产生,由此推知Mg(OH)Cl分解后产物中没有MgCl2;故填:MgCl2;
【结论】由以上分析可知,Mg(OH)Cl受热分解生成氧化镁和氯化氢气体,反应的化学反应方程式为:Mg(OH)Cl $\frac{\underline{\;\;△\;\;}}{\;}$ MgO+HCl↑;故填:Mg(OH)Cl $\frac{\underline{\;\;△\;\;}}{\;}$ MgO+HCl↑;
点评 本题是实验推断题,熟练掌握各物质间的相互反应关系是解答问题的关键.


科目:初中化学 来源: 题型:选择题
| A. | 都含有氢、氧元素 | |
| B. | 都由氢、氧原子构成,结构相同 | |
| C. | 一定条件下都能分解产生氧气 | |
| D. | H2O是常见的溶剂,H2O2溶液可用于医疗消毒 |
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
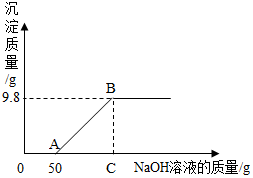 现有硫酸和硫酸铜的混合溶液200g,向该溶液中逐滴加入质量分数为10%的氢氧化钠溶液直至生成Cu(OH)2沉淀,沉淀质量与所加入的氢氧化钠溶液的质量关系如图所示.求:
现有硫酸和硫酸铜的混合溶液200g,向该溶液中逐滴加入质量分数为10%的氢氧化钠溶液直至生成Cu(OH)2沉淀,沉淀质量与所加入的氢氧化钠溶液的质量关系如图所示.求:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 若甲、乙各取10g混合,使其充分反应,则丙、丁质量的总和一定等于20g | |
| B. | 若丙为沉淀,则甲、乙中有一种物质是碱 | |
| C. | 若该反应为复分解反应,则生成物中一定有水 | |
| D. | 若乙和丁为单质,甲和丙为化合物,则该反应一定为置换反应 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 用量筒量取一定量的水,读数时要平视液体凹形液面中央最低处 | |
| B. | 制作糖水时候,用玻璃棒搅拌可以加快糖的溶解 | |
| C. | 在用烧杯配制氢氧化钠溶液时,将氢氧化钠溶于水,会感觉烧杯壁比较热 | |
| D. | 因为氯化钠没有腐蚀性,所以可以直接在托盘天平上称量 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
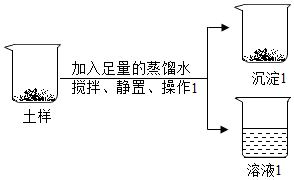 经过监测和治理,我省的土壤质量已经得到了很好的改善,但个别地区仍然存在盐碱地.某校化学兴趣小组的同学们为此开展了实践活动,他们采集了本地的土样,并对土样围绕两个问题进行探究
经过监测和治理,我省的土壤质量已经得到了很好的改善,但个别地区仍然存在盐碱地.某校化学兴趣小组的同学们为此开展了实践活动,他们采集了本地的土样,并对土样围绕两个问题进行探究| 验证猜想所用试剂 | 实验现象 | 实验结果 | |
| 方案一 | AgNO3溶液和稀硝酸 | 由白色沉淀生成 | 猜想①正确 |
| 方案二 | 碳酸钠溶液 | 无明显现象 | 猜想②不正确 |
| 方案三 | 稀盐酸 | 有气泡产生 | 猜想③正确 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 实验图示 |  | 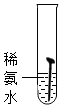 | 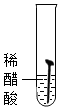 | 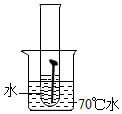 | 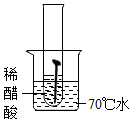 |
| 生锈时间 | 8min | 较长时间不生锈 | 5min | 3min | 1min |
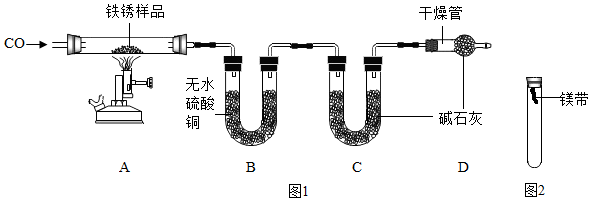
| 铁锈样品的质量/g | 装置B的质量/g | 装置C的质量/g | |
| 反应前 | 23.2 | 232.4 | 198.2 |
| 反应后 | / | 239.6 | 211.4 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
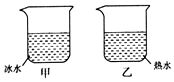 夏天,小丽将冰水和热水分别注入常温下的两只透明烧杯中,如图所示,一会儿发现两只烧杯的杯壁上都有一部分出现小水珠,变得模糊了.针对这一现象,下列说法正确的是( )
夏天,小丽将冰水和热水分别注入常温下的两只透明烧杯中,如图所示,一会儿发现两只烧杯的杯壁上都有一部分出现小水珠,变得模糊了.针对这一现象,下列说法正确的是( )| A. | 甲、乙两杯都在内壁出现了水珠 | |
| B. | 甲、乙两杯都在外壁出现了水珠 | |
| C. | 甲杯的内壁出现了水珠,乙杯的外壁出现了水珠 | |
| D. | 甲杯的外壁出现了水珠,乙杯的内壁出现了水珠 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com