(2010?湘潭)纯碱(Na
2CO
3)水溶液的pH ①______ (填“大于”“小于”或“等于“)7.某活动小组的同学准备利用氢氧化钙、纯碱制得烧碱(NaOH),反应的化学方程式为Na
2CO
3+Ca(OH)
2═CaCO
3↓+2NaOH,他们将这两种物质的溶液混合后过滤,得滤渣和滤液,对滤液中溶质的成分进行探究:
【思考与交流】(1)从反应方程式可知,滤液中一定有 ②______ (填化学式).若往其中加入酚酞试液,则溶液显③______色.
(2)由于反应物的用量未控制好,所以滤液中还可能有多余的反应物.
【猜想与假设】小肖同学认为:可能还有Na
2CO
3和Ca(OH)
2.小谭同学认为:可能还有Na
2CO
3.小张同学认为:可能还有Ca(0H)2.【讨论与交流】经过讨论,大家一致认为 ④______ 同学的猜想不合理.其理由是⑤______.
【活动与探究】小谭同学取原滤液向其中加入CaCl
2溶液,观察到⑥______,于是得出该滤液的溶质中还有Na
2CO
3的结论,证实了自己的猜想.小张同学取原滤液向其中加入Na
2CO
3溶液,无现象,据此否定了自己的猜想;他又重新取原滤液,向其中倾倒一定量的稀硫酸,观察到 ⑦______,得到了和小谭同学相同的结论.
经过上述同学的共同努力,大家终于对滤液中溶质的成分得出了正确结论.
【探索与拓展】现有一份由NaOH和Na
2CO
3组成的混合物29.2克.为测定其中Na
2CO
3的质量分数,该实验小组先将稀硫酸溶液逐渐加入上述混合物中,发生反应:Na
2CO
3+H
2SO
4═Na
2SO
4+CO
2↑+H
2O,产生气体的质量与所加稀硫酸质量的关系如图所示(假设A点处所加稀硫酸恰好反应完全).据图计算:(1)原混合物中Na
2CO
3的质量分数.(2)A点所示溶液中溶质的质量分数.(计算结果保留小数点后一位)
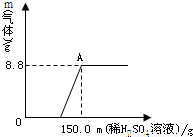


 =
= x=21.2g
x=21.2g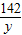 =
=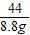 y=28.4g
y=28.4g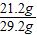 ×100%=72.6%
×100%=72.6% =
=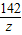 z=14.2g
z=14.2g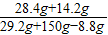 ×100%=25%
×100%=25%

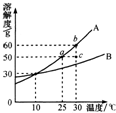 (2010?湘潭)图是A、B两种固体物质的溶解度曲线.据图回答:
(2010?湘潭)图是A、B两种固体物质的溶解度曲线.据图回答: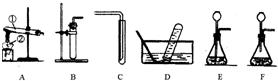 (2010?湘潭)下图中A、B是实验室制取气体时的常用装置.请按要求填空:
(2010?湘潭)下图中A、B是实验室制取气体时的常用装置.请按要求填空: