
【题目】以软锰矿粉(主要含MnO2,还有少量Fe2O3)为原料制取MnCO3的流程如图1.
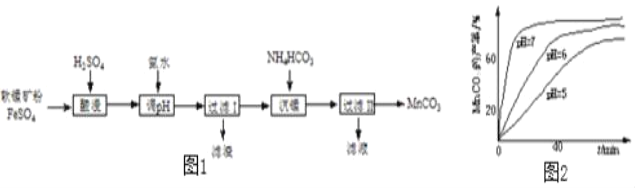
(1)“酸浸”时发生的反应有2FeSO4+MnO2+2H2SO4=_____+MnSO4+2H2O和_____。
(2)“过滤Ⅰ”所得滤渣的主要成分是_____。
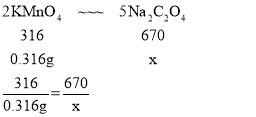
(3)“沉锰”时测得MnCO3的产率与溶液pH、反应时间t的关系如图2,反应要控制pH=_____,其理由是_____、_____。
(4)“过滤Ⅱ”所得滤液中溶质的主要成分是_____。
(5)为测定某软锰矿中MnO2的质量分数,称取2.0 g软锰矿样品,加入3.35 g草酸钠(Na2C2O4)固体,再加足量稀硫酸(杂质不参加反应),充分反应后,过量的Na2C2O4用31.6 g/L KMnO4溶液进行反应,当滴入10.0 mL KMnO4溶液时恰好完全反应。
已知:①MnO2+Na2C2O4+2H2SO4=MnSO4 +2CO2↑+2H2O+Na2SO4 ;②2KMnO4+5Na2C2O4+8H2SO4=2MnSO4+5Na2SO4+K2SO4+10CO2↑+8H2O.
求该软锰矿中MnO2的质量分数。_____(相对分子质量:KMnO4 158;Na2C2O4 134;MnO2 87)
【答案】Fe2(SO4)3 Fe2O3+3H2SO4=Fe2(SO4)3+3H2O Fe(OH)3 7 时间相同时,MnCO3的产率最高 MnCO3产率相同时,所需时间最短;(或者简单答成:产率高、速度快) (NH4)2 SO4 87%
【解析】
(1)由于软锰矿粉(主要含MnO2,还有少量Fe2O3),所以“酸浸”时发生的反应是氧化铁和硫酸反应生成硫酸铁和水,以及硫酸亚铁和二氧化锰以及硫酸反应生成硫酸铁和硫酸镁以及水,对应的化学方程式为:2FeSO4+MnO2+2H2SO4=Fe2(SO4)3+MnSO4+2H2O和 Fe2O3+3H2SO4=Fe2(SO4)3+3H2O。
(2)由于后续得到的是含锰化合物,所以过滤操作中分离出的应该是含铁化合物,而过程是和氨水反应得到且酸浸过程中生成的是三价铁的化合物,所以“过滤Ⅰ”所得滤渣的主要成分是难溶性的 Fe(OH)3。
(3)根据“沉锰”时测得MnCO3的产率与溶液pH、反应时间t的关系图,可知反应要控制pH=7,其理由是 时间相同时,MnCO3的产率最高、MnCO3产率相同时,所需时间最短。
(4)过滤II前是硫酸锰和碳酸氢铵反应生成碳酸锰和溶液,根据质量守恒定律,可知溶液的成分为硫酸铵,所以“过滤Ⅱ”所得滤液中溶质的主要成分是 (NH4)2SO4。
(5)当滴入10.0 mL KMnO4溶液时恰好完全反应,则消耗的高锰酸钾的质量为31.6 g/L×10.0 mL×1L/1000mL=0.316g
设与高锰酸钾反应的草酸钠的质量为x
x=0.67g
则与二氧化锰反应的草酸钠的质量为3.35g﹣0.67g=2.68g
设该软锰矿中MnO2的质量分数为y
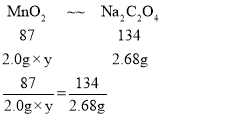
y=87%
故答案为:
(1)Fe2(SO4)3;Fe2O3+3H2SO4=Fe2(SO4)3+3H2O;(2)Fe(OH)3;(3)7; 时间相同时,MnCO3的产率最高; MnCO3产率相同时,所需时间最短;(或者简单答成:产率高、速度快);(4)(NH4)2 SO4;(5)87%。


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:
【题目】如图是A、B两种固体物质的溶解度曲线。
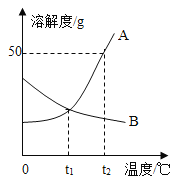
(1)当温度为________℃时,A、B两种物质的溶解度相等。
(2)欲使饱和状态的B溶液变成不饱和溶液,可采用的一种方法是________。
(3)t2℃时,将30gA物质加入50g水中,充分溶解后,所得溶液中溶质与溶液的质量比是________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】我国化工专家侯德榜的“侯氏制碱法”为世界制碱工业作出了突出的贡献。他以食盐、水、氨气、二氧化碳为原料,先制得碳酸氢钠和氯化铵,进而生产出纯碱。表格中是几种物质在不同温度时的溶解度:
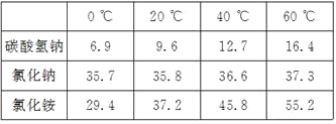
(1)从表中数据可以看出,温度对_____的溶解度影响不大。
(2)要使氯化铵饱和溶液中的氯化铵结晶析出,在____(填“较高”或“较低”)温度下进行比较合适。
(3)写出“侯氏制碱法”制碳酸氢钠的方程式_____。
(4)有人认为侯氏制碱法的优点有四:
A 生产过程中部分产品可选为起始原料使用
B 副产品是一种可利用的氮肥
C 反应不需要加热
D副产物不会造成污染环境
你认为其中正确的是___。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】经测定某氯化钠样品中混有硫酸钠,为了除去杂质并制得纯净的氯化钠固体,某同学设计方案如下:
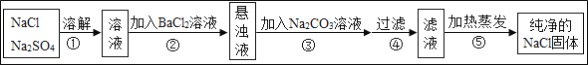
回答下列问题:
(1)操作②能否用硝酸钡溶液,并说明理由__________。
(2)此方案设计的是否严密,请说明理由______________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】日常生活、社会发展与化学密切相关。
每100 g莲藕中含有16.2 g糖类、0.9 g蛋白质、0.1 g脂肪,以及丰富的维生素A、维生素C和铁、钙等元素。

①糖类的组成元素有_____。
②人误食重金属盐中毒后,为减轻毒性,最好服用_____。(填序号)
a蛋清 b乙酸铅溶液 c水
③下列食物中富含淀粉的是_____。(填序号)
a土豆 b牛奶 c豆油
④缺_____元素可能导致骨骼疏松、畸形,易得佝偻病。
⑤人体不可缺少的营养物质有蛋白质、糖类、脂肪、矿物质、水和_____。
⑥糖类、蛋白质、脂肪和维生素中能为人体提供能量的有_____、_____、和糖类。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某化学兴趣小组的同学来到实验室准备做制取气体的实验。如图是实验室制取气体的常用装置:

(1)写出图中标号仪器的名称:a_____;b_____。
(2)实验室常用B装置作为制取氧气的发生装置,写出反应的化学方程式_____。
(3)小组同学想用大理石和稀盐酸反应制取CO2,则他选择B装置作气体发生装置的优点是_____,若要制得干燥的CO2,还应该将气体通入_____(填装置编号,下同)装置。
(4)甲烷是一种无色、无味、难溶于水、密度小于空气的气体,实验室常用加热无水醋酸钠和碱石灰固体混合物的方法制取甲烷,则选用的发生装置和收集装置分别为_____、_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】已知甲、乙、丙、丁分别是初中化学中常见的四种不同类别的物质,相邻两种物质可发生化学反应,生成A、B、C、D四种物质(部分生成物已略)。其中乙是应用最广的金属,丙是蓝色溶液,丁中含有钠离子,B是气体,D是不溶性碱。
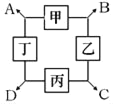
(1)写出乙的化学式_____;
(2)若C是一种盐,则其溶液的颜色为_____;
(3)甲所属的物质类型为_____(填“酸”“碱”“盐”或“氧化物”);
(4)若丙由三种元素组成,试写出丙与丁反应的化学方程式_____;
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】根据下列装置图回答问题:
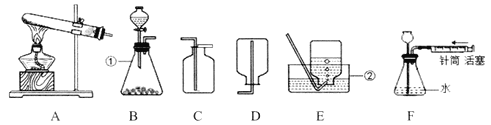
(1)写出标号仪器的名称:①_____,②_____。
(2)实验室用高锰酸钾制取氧气的化学方程式为_____;如用E装置收集氧气,当观察到_____时,再把导管口伸入盛满水的集气瓶里。
(3)乙炔(C2H2)是重要的化工原料。实验室用电石(CaC2块状固体)与水反应来制取乙炔气体,应选用的发生装置是_____。
(4)小明同学用B、C装置组合制取二氧化碳,当用燃着的小木条放在C装置瓶口时,发现小木条始终不熄灭,说明气体没有集满,可能的原因是_____。
(5)检查F装置气密性的方法是:当把针筒中的活塞内推后,静置观察,若看到_____,说明气密性良好。
(6)实验室用锌与浓盐酸反应制取纯净、干燥的氢气,可将制得的气体先通过盛有________的洗气瓶,再通过盛有_____的洗气瓶。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下图是某反应的微观示意图,关于该反应的说法中,正确的是
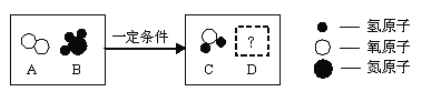
A. 反应前后,分子种类不变B. 若D为单质,则C、D质量比为9:14
C. 该反应一定为置换反应D. 该反应中,一定有元素化合价改变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com