
 如图所示是甲、乙两种固体物质的溶解度曲线.下列说法中正确的是( )
如图所示是甲、乙两种固体物质的溶解度曲线.下列说法中正确的是( )| A. | 甲物质的溶解度大于乙物质的溶解度 | |
| B. | t2℃时,向甲的饱和溶液中加入少量水,甲的溶解度变小 | |
| C. | 乙物质的饱和溶液从t2℃降到t1℃时,溶液中溶质的质量分数保持不变 | |
| D. | t2℃时,甲、乙两物质各50g,分别充分溶解于100g水中,得到的溶液质量分数相同 |
分析 根据固体的溶解度曲线可以:①查出某物质在一定温度下的溶解度,从而确定物质的溶解性,②比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小,③判断物质的溶解度随温度变化的变化情况,从而判断通过降温结晶还是蒸发结晶的方法达到提纯物质的目的.
解答 解:A、在比较物质的溶解度时,需要指明温度,故A错误;
B、固体物质的溶解度受温度影响,不会随溶剂的改变而变化,故B错误;
C、乙物质的饱和溶液从t2℃降到t1℃时,会析出晶体,溶液中溶质的质量分数减小,故C错误;
D、t2℃时,甲、乙物质的溶解度是50g,所以将甲、乙两物质各50g,分别充分溶解于100g水中,得到的溶液质量分数相等,故D正确.
故选:D.
点评 本题难度不是很大,主要考查了固体的溶解度曲线所表示的意义,及根据固体的溶解度曲线来解决相关的问题,从而培养分析问题、解决问题的能力.


科目:初中化学 来源: 题型:实验探究题
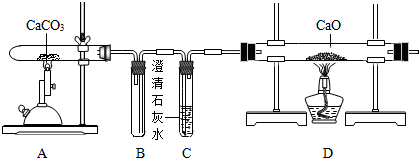
| 实验步骤 | 实验现象 | 实验结论 |
| 取少量D中固体加入试管中,加水震荡,滴入无色酚酞试液, 再向试管中加入足量的稀盐酸 | 溶液变红 有气泡产生 | 猜想Ⅱ成立 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
 常温时,该物质在不同质量的水中溶解达到饱和状态,溶质的质量与水的质量关系如图所示,下列说法错误的是( )
常温时,该物质在不同质量的水中溶解达到饱和状态,溶质的质量与水的质量关系如图所示,下列说法错误的是( )| A. | 常温时,该物质的溶解度是40g | |
| B. | D点时,该溶液已达到饱和状态 | |
| C. | 加溶质,能使A点状态的溶液变化到C点状态 | |
| D. | 图中各处溶液的溶质质量分数由小到大是A、B、C |
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 实验操作 | 预期现象 | 结论 |
| 步骤1:取少量固体于试管中,滴加适量的稀盐酸或稀硫酸 | 不产生气泡 | 假设2成立 |
| 步骤2:另取少量固体于另一支试管中,加足量的水溶解,滴加适量的氯化钡溶液 | 不产生白色沉淀 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 气体更易被压缩--构成气体的分子具有弹性 | |
| B. | 液氧为淡蓝色--氧气分子是蓝色的 | |
| C. | 湿衣服变干--水分子在不断地运动 | |
| D. | 碘受热升华--碘分子变大了 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
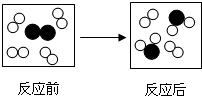
| A. | 该反应中元素的化合价不变 | |
| B. | 在该化学反应中,分子可分,原子不可分 | |
| C. | 参加反应的物质分子个数比为1:4或4:1 | |
| D. | 该反应时置换反应 |
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 |
| NH4Cl溶解度/g | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 |
| NaCl溶解度/g | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
| 温度/℃ | 20 | 40 | 60 | 80 | |
| 溶解度/g | NaCl | 36.0 | 36.6 | 37.3 | 38.4 |
| KNO3 | 31.6 | 63.9 | 110 | 169 | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com