
酸、碱、盐是几类有广泛用途的重要化合物.
(1)酸和碱在组成和性质方面有很多共同的特点,请任写出其中的一条.
(2)氢氧化钙是一种常见的碱,列举其在生产、生活中的一种用途.
(3)某化学兴趣小组在实验室发现了一瓶标签受到腐蚀(如右图)的溶液,他们对此产生了兴趣.
提出问题:这瓶溶液究竟是什么?
经过询问实验老师平时的药品保管得知,这瓶无色溶液应该是碳酸钠、碳酸氢钠、氯化钠、硫酸钠、硝酸钠中的某一种.为了确定该药品,他们首先进行了理论分析:
①小明根据标签上的组成元素认为一定不可能是 (提示:只有其中一种).
②小英提出,碳酸氢钠、硝酸钠也不可能,你认为她的依据是:
设计实验:为了确定该溶液究竟是剩余两种盐的哪一种,他们设计了如下实验.
| 实验操作 | 实验现象 |
| 取少量样品于试管中,慢慢滴加BaCl2溶液 | 出现白色沉淀 |
| 静置一段时间后,倾去上层清液,向沉淀中滴加稀盐酸 | 白色沉淀全部溶解,并产生大量气泡 |

(1)组成上都含有氢元素(或都能使指示剂变色或都有腐蚀性等);(2)改良酸性土壤(或粉刷墙壁、配制农药波尔多液等); (3)①氯化钠;②这两种物质的化学式中Na元素的右下角不会有2; ③碳酸钠溶液; BaCl2 +Na2CO3═BaCO3↓+2NaCl; ④取少量无色溶液样品于试管中,慢慢滴加稀盐酸;(4)答:反应后所得溶液的质量分数为11.7%.
解析试题分析:(1)酸、碱在组成和性质上的相似点有:组成中都含有氢元素,都能使指示剂变色,有腐蚀性等;(2)氢氧化钙显碱性,且比较廉价,农业上常用来改良酸性土壤,并可于硫酸铜反应用来配制农药波尔多液,还是一种常用的建筑材料等;(3)①该标签显示该物质中一定含有钠元素、氧元素,而氯化钠不含有氧元素,所以从组成上可以判断该物质一定不是氯化钠;②碳酸氢钠和硝酸钠的化学式中钠元素的右下角数字是1,而不是2,所以不可能是碳酸氢钠和硝酸钠;③硫酸钠、碳酸钠可与氯化钡溶液反应分别生成硫酸钡、碳酸钡沉淀,但硫酸钡沉淀与稀盐酸不反应,碳酸钡沉淀可与稀盐酸反应生成氯化钡、水和二氧化碳,所以根据向沉淀中加入稀盐酸,白色沉淀全部溶解,并产生大量气泡可知该瓶溶液是碳酸钠溶液,碳酸钠和氯化钡反应生成碳酸钡沉淀和氯化钠,反应方程式是BaCl2 +Na2CO3═BaCO3↓+2NaCl;④碳酸钠可与盐酸反应生成二氧化碳,而硫酸钠与盐酸不反应,所以可取样品滴加稀盐酸观察是否有气泡生成进行判断,这样操作步骤更简洁;
(4)设反应后生成氯化钠的质量为 x
HCl+NaOH═NaCl+H2 O
36.5 58.5
73g×20% x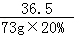 =
=
x="23.4" g
反应后所得溶液的质量分数为: ×100%═11.7%
×100%═11.7%
考点:酸的化学性质;缺失标签的药品成分的探究;有关溶质质量分数的简单计算;常见碱的特性和用途;碱的化学性质;常见离子的检验方法及现象;化学式的书写及意义;书写化学方程式、文字表达式、电离方程式;根据化学反应方程式的计算.


 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案科目:初中化学 来源: 题型:探究题
学习了氢氧化钠的性质之后,知道氢氧化钠溶液中含有H2O、Na+、OH-,能使无色酚酞试液变红色,某科技小组想进一步探究是哪一种粒子使无色酚酞试液变红色。
【提出猜想】猜想①:可能是H2O ;猜想②:可能是Na+;猜想③:可能是OH-。
【实验验证】
| 实验操作 | 实验现象 | 结 论 |
| ①用试管取少量蒸馏水,滴入1滴~2滴无色酚酞试液,振荡 | 试管内溶液仍为无色 | 水分子不能使无色酚酞试液变红色 |
| ②用试管取少量氯化钠溶液,滴入1滴~2滴无色酚酞试液,振荡 | | |
| ③用试管取少量氢氧化钠溶液,滴入1滴~2滴无色酚酞试液,振荡 | | |
查看答案和解析>>
科目:初中化学 来源: 题型:探究题
下图装置可以完成多个简单实验,具有药品用量少、实验现象明显、尾气不外逸等优点。
小资料:Na2CO3 + H2SO4=Na2SO4 + H2O + CO2↑;
氧化钙(俗称生石灰)与水反应放热。
(1)若甲中吸有浓氨水,乙中吸有无色酚酞溶液,将甲、乙中的液体同时挤出,一段时间后,观察到无色酚酞溶液变红,说明分子具有的性质是________。
(2)若甲中吸有水,乙中吸有稀硫酸,烧杯①中盛有用石蕊溶液染成紫色的干燥纸花,烧杯②中盛有碳酸钠粉末。为了验证使石蕊变色的物质是碳酸而不是二氧化碳,应采取的实验操作是________。
(3)若先将甲中的液体挤出,观察到气球明显鼓起,一段时间后恢复原状;再将乙中的液体挤出,气球又明显鼓起。请将下表中的试剂补充完整。
| | 滴管甲 | 烧杯① | 滴管乙 | 烧杯② |
| 试剂 | H2O | | | MnO2 |
查看答案和解析>>
科目:初中化学 来源: 题型:探究题
某化学小组测定空气中氧气的体积分数。
(1)根据右图回答问题。
①红磷燃烧的化学方程式为 。
②若将红磷改为木炭,反应结束后降至室温,打开止水夹,烧杯中的水不倒吸入集气瓶的原因是 _。
(2)用四硫化钠(Na2S4)固体可替代红磷测定空气中氧气的体积分数。
反应原理为:2Na2S4+O2+2H2O=8S↓+4NaOH(氢氧化钠)。
小资料:四硫化钠(Na2S4)与氧气、水反应生成难溶于水的固体硫(S)和易溶于水
的氢氧化钠。
【实验过程】
①取足量的四硫化钠固体加入试管中,再加入适量的水,迅速塞紧橡胶塞,充分振荡。测量液面至橡胶塞下沿的距离,记录数据h1(如图1所示)。
图1 图2
②将该试管插入水中(如图2所示),拔下橡胶塞,观察到 ,塞紧橡胶塞。将试管取出,倒转过来,测量液面至橡胶塞下沿的距离,记录数据h2。理论上h2∶h1= 。
③按照①和②再重复实验2次。3次实验数据如下表所示。
| | 第1次 | 第2次 | 第3次 |
| h1/cm | 11.0 | 11.4 | 11.6 |
| h2/cm | 8.7 | 9.1 | 9.2 |
查看答案和解析>>
科目:初中化学 来源: 题型:探究题
某化学兴趣小组回收利用废旧干电池。
实验1 回收填料中的二氧化锰和氯化铵
查阅资料:废旧干电池填料的主要成分为二氧化锰、炭粉、氯化铵和氯化锌等,其中氯化铵、氯化锌可溶于水。兴趣小组的同学们设计回收物质的流程如图1所示。
(1)操作1和操作2的名称都是___________,该操作中玻璃棒的作用是__________。
(2)灼烧滤渣l的目的是____________________________。
实验2利用外壳回收物锌制取氢气及相关探究
(3)用锌和稀硫酸制取氢气。己知氢气密度比空气小且难溶于水,提供装置如图2。
①应选择:发生装置为____(填编号),排空气法收集装置为____(填编号)。
②若用排水法收集并测定气体的体积,气体从装置B导管口接____(填“a”或“b”) 进;选用仪器F测量排出水的体积,仪器F名称是___________________。
(4)探究影响锌与稀硫酸反应快慢的因素。反应过程中,用前10min内收集的氢气体积比较反应的快慢。控制其他条件相同,进行下表四组实验,获得数据如下表。
| 验实号编 | 试 剂 | 前 10min 内产生的氢气体积(mL) | |
| 不同纯度的锌 | 不同体积和浓度的稀硫酸 | | |
| a | 纯锌 | 30mL 30% | 564.3 |
| b | 含杂质的锌 | 30mL 30% | 634.7 |
| c | 纯锌 | 30mL 20% | 449.3 |
| d | 纯锌 | 40mL 30% | 602.8 |
查看答案和解析>>
科目:初中化学 来源: 题型:探究题
同学们对实验“煅烧石灰石”展开深入探究。
(1)煅烧石灰石。可观察到石灰石的表面 。
(2)为证明石灰石已分解,三位同学从其他角度设计方案如下:
Ⅰ.甲同学按图一所示进行实验(煤气灯亦能达到石灰石分解的温度),观察到烧杯内壁石灰水变浑浊,写出石灰水发生反应的化学方程式__ __。
II.乙同学按图二所示进行试验,观察到B中液体变 色,A中实验的作用 。
III.丙同学取一块石灰石进行煅烧,一段时间后发现固体质量减轻mg(即CO2的质量),证明石灰石已分解。
IV.大家认为甲同学的方案不合理,请分析原因 _ 。
(3)为测定石灰石的纯度,丙同学将他刚才煅烧后的固体放入足量稀盐酸中,又产生mg气体,结合上述数据计算可知,丙所取的这块石灰石中含碳酸钙 _ mol(用m表示)。
查看答案和解析>>
科目:初中化学 来源: 题型:探究题
某气体中可能含有CO、CO2和H2中一种或几种,为了确定该气体的组成,某实验小组按如下装置进行实验。
(1)实验现象:A、D装置中均有白色沉淀产生;B装置中黑色粉末变成亮红色;C装置中有明显现象,该现象是 。
(2)依据上述实验现象,该气体的组成是 。装置A中澄清石灰水的作用是 ,写出该反应的化学方程式 。
(3)问题与反思:实验结束后,某同学对上述实验设计提出质疑,认为没有达成实验目的。下面请你一起对上述实验装置中所存在的问题进行改进: 。
查看答案和解析>>
科目:初中化学 来源: 题型:探究题
某兴趣小组在学习碱的化学性质时,进行了如下所示的实验.
(1)实验①中盐酸和氢氧化钠反应的化学方程式为 .
(2)实验②中观察到试管内有白色沉淀产生,反应的化学方程式为 .
(3)实验③中滴加氢氧化钠溶液后,可观察到的现象是 .
实验结论:碱能与多种类别的物质发生反应,包括指示剂、非金属氧化物、酸和盐类等.
【反思交流】实验结束后,同学们对实验②的废液成分进行了探究:将实验②的废液进行过滤,滤渣所含的成分是 .
【提出问题】滤液中所含溶质是什么物质呢?
【做出猜想】猜想一:滤液中的溶质是氢氧化钠.
猜想二:滤液中的溶质是氢氧化钠和碳酸钠.
猜想三:滤液中的溶质是氢氧化钠和 .
【实验设计】同学们取滤液样品并加入酚酞溶液,溶液呈红色,继续逐滴加入稀盐酸,发现溶液逐渐变无色,同时有气泡产生.由此得出结论,猜想 正确.
查看答案和解析>>
科目:初中化学 来源: 题型:探究题
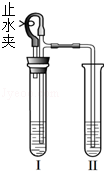
用如图所示装置分别进行两个实验(已知:氯化钙溶液呈中性).
(1)打开止水夹,向Ⅰ中液体加入一种黑色固体、Ⅱ中液体加入一种白色固体.Ⅰ和Ⅱ中均有气泡出现,且Ⅱ中液体内出现燃烧现象.
①写出燃烧反应的化学方程式 .
②请说明Ⅱ中出现燃烧的原因 .
(2)打开止水夹,向Ⅰ中液体加入一小块固体.Ⅰ和Ⅱ中均有气泡出现,且Ⅱ中液体出现浑浊现象.关闭止水夹,发现Ⅱ中液面上升,溶液由浑浊变澄清.
①请说明溶液由浑浊变澄清的原因 .
②若实验后Ⅱ中澄清液中的溶质由一种或两种物质组成,为检验其成分,应该进行的实验操作是
.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com