
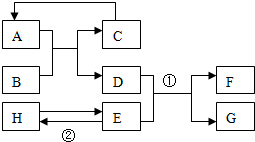
 已知A-H均为初中化学常见的物质,其中A、C是组成元素相同的气体,且C能产生温室效应:是赤铁矿的主要成分;F是紫红色金属;H是蓝色沉淀.根据如图所示的转化关系(图中反应条件均已略去),请回答:
已知A-H均为初中化学常见的物质,其中A、C是组成元素相同的气体,且C能产生温室效应:是赤铁矿的主要成分;F是紫红色金属;H是蓝色沉淀.根据如图所示的转化关系(图中反应条件均已略去),请回答:分析 根据题目中的突破口C能产生温室效应”,所以C是二氧化碳,A、C是组成元素相同的气体,所以A是一氧化碳,“B为红棕色,是赤铁矿的主要成分”、所以B是氧化铁,“F是紫红色金属,故F是铜;H是蓝色沉淀”,H是氢氧化铜沉淀,再进一步进行分析即可.
解答 解:C能产生温室效应”,所以C是二氧化碳,A、C是组成元素相同的气体,所以A是一氧化碳,“B为红棕色,是赤铁矿的主要成分”、所以B是氧化铁,一氧化碳还原氧化铁生成二氧化碳和铁,故C是二氧化碳,D为铁,H是蓝色沉淀”,故H是氢氧化铜沉淀,“F是紫红色金属,故F是铜;D与E反应产生铜,故E为铜盐溶液,由E铜盐溶液制取氢氧化铜可跟碱溶液反应.
(1)由上述分析可知C是二氧化碳,化学式是CO2;
(2)由上述分析可知D为铁,E为铜盐溶液,铜盐溶液与碱反应可制取氢氧化铜沉淀,反应的化学方程式为
CuSO4+2NaOH=Cu(OH)2↓+Na2SO4;
(3)硫铁矿主要含FeS,在高温下,将硫铁矿的粉末与氧气充分反应生成三氧化二铁和二氧化硫,反应的化学方程式为:FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2.
故答案为:
(1)CO2;(2)CuSO4+2NaOH=Cu(OH)2↓+Na2SO4;
(3)FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2.
点评 解答本题关键是要找出突破口,知道造成温室效应的主要气体是二氧化碳,赤铁矿的主要成分是氧化铁,紫色金属是铜,蓝色沉淀是氢氧化铜,再根据学过去的知识进一步进行分析推断即可.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:初中化学 来源: 题型:选择题
| A. | 净化水的方法有吸附、沉降、过滤和蒸发等 | |
| B. | 水通电分解产生的正极和负极的气体体积比为2:1 | |
| C. | 为了增强水的导电性在电解水实验中需加入少量氯化钠 | |
| D. | 为了防止水结冰可在汽车水箱中加入少量乙二醇 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 次数 | 第一次 | 第二次 | 第三次 |
| 加入稀硫酸质量/g | 10 | 10 | 10 |
| 生成氢气质量/g | 0.04 | 0.04 | 0.02 |
查看答案和解析>>
科目:初中化学 来源: 题型:多选题
| A. | 3g碳在100g氧气中充分燃烧生成103g二氧化碳 | |
| B. | 100mL98%的浓硫酸用100mL水稀释,可得到溶质质量分数为49%的硫酸 | |
| C. | 用含杂质(杂质不与酸反应,也不溶于水)的铁10g 和50g 稀硫酸完全反应后,滤去杂质,所得液体质量为55.4g,则含杂质的铁中铁的质量分数为56% | |
| D. | MgO与CuO的混合物与98g10%的稀硫酸恰好完全反应,则原混合物中氧元素的质量是1.6g |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 滤液M中可能存在Fe2+ | |
| B. | 滤液M中一定含有两种金属阳离子 | |
| C. | 滤渣N中一定没有单质镁 | |
| D. | 滤渣N的质量一定大于加入铁粉的质量 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
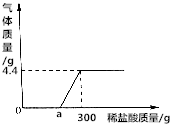 取24.8gCaCO3和Ca(OH)2固体混合物于烧杯中,向烧杯中不断加入质量分数为7.3%的稀盐酸.反应过程中测得生成气体的质量与所加稀盐酸质量的关系如图所示.
取24.8gCaCO3和Ca(OH)2固体混合物于烧杯中,向烧杯中不断加入质量分数为7.3%的稀盐酸.反应过程中测得生成气体的质量与所加稀盐酸质量的关系如图所示.查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com