
为从定量角度认识中和反应,小明同学自行设计并进行了下面实验:
①在小烧杯中倒人8%的氢氧化钠溶液l0g,滴入2滴酚酞试剂后,溶液呈红色;
②另取10%的稀盐酸逐滴滴加到氢氧化钠溶液中,边滴边振荡,随盐酸滴入,溶液颜色逐渐变浅;
③在溶液红色消失瞬间,停止实验。
若停止实验时,两溶液恰好反应。请分析小明实验后回答:
(1)实验中酚酞试剂的作用是_________________________;
(2)计算出这时共用去稀盐酸的质量是多少?(精确到0.1
 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:初中化学 来源: 题型:填空题
农技人员采用“测土配方”技术对一片果园进行了土壤检测,结果显示该果园需要补充一定量的氮元素和钾元素。
(1)氮是植物生长的重要元素,果园土壤中缺少氮元素,需要用氮肥来补充,下列属于氮肥的是 (填序号)。
①KCl; ②NH4HCO3; ③Ca3(PO4)2。
(2)“测土配方”可以实现“缺什么、补什么”,使用该技术的好处是 。
(3)某同学取丰收牌钾肥(如图1)样品2.0g,溶于足量的水中,滴加过量氯化钡溶液,产生沉淀质量与所加氯化钡溶液质量的关系如图2。试通过计算判断该钾肥中硫酸钾的质量分数是否符合产品外包装说明?(反应方程式为:K2SO4+BaCl2=BaSO4↓+2KCl,杂质不参加反应。)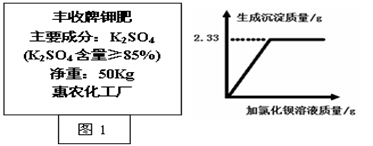
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
我国制碱工业的先驱——侯德榜探索发明了“侯氏制碱法”,其生产过程涉及的主要化学反应如下:
①NH2+CO2+X=NH4HCO3
②NH4HCO3+NaCl=NH4Cl+NaHCO3↓
③2NaHCO3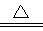 Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
请回答下列问题:
(1)反应①中X的化学式为 。
(2)除去混在Na2CO3粉末中少量的NaHCO3的方法是 。
(3)工业纯碱中含有氯化钠,取55g工业纯碱,向其中加入269.5g稀盐酸,恰好完全反应,生成22g二氧化碳,求:
①工业纯碱中碳酸钠的质量分数。(计算结果保留到0.1%)
②反应后溶液中溶质的质量分数。
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
某长期暴露在空气中的烧碱样品已部分变质,为了测定其纯度,现进行如下实验:取样品18.6g加入到85.8g水中充分搅拌至完全溶解,向所得溶液中逐滴滴加稀盐酸,产生气体的质量与所加稀盐酸质量的关系如图所示。分析题意并回答下列问题: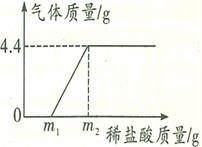
(1)反应过程中生成气体的质量是 。
(2)该烧碱样品中氢氧化钠的质量是多少克(写出规范的解题过程)?
(3)所用稀盐酸的溶质质量分数是 (用ml和m2表示)。
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
CO2和CO的混合气体3.6g与足量灼热的氧化铁充分反应后,将生成的气体全部通入80克质量分数为20%的氢氧化钠溶液中充分吸收,测得最终所得溶液的质量为84.4克,则原混合气体中CO质量为( )
| A.4.4g | B.2.8g | C. 1.4g | D.0.8g |
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
(7分)为综合利用生产过程中的副产品CaSO4,某化工厂设计了以下制备(NH4)2SO4的工艺流程: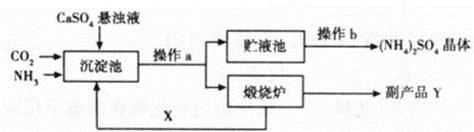
(1)此流程中,在沉淀池发生的化学反应为CO2+2NH3+CaSO4+H2O==CaCO3↓+ (NH4)2SO4
在煅烧炉中发生的化学反应方程式为 ;该工艺中可循环使用的X为 (填化学式);副产品Y有何用途 (填一种即可)。
(2)从贮液池中获得(NH4)2SO4晶体要进行操作b,操作b是 。若经过一定处理后的贮液池中,形成30℃时(NH4)2SO4的饱和溶液,则此时溶质质量分数为 (已知30℃时硫酸铵的溶解度为78g)。
(3)欲制备6.6t (NH4)2SO4晶体,理论上需要CaSO4多少吨?
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
小丽将铁粉和铜粉组成的7g混合物放入盛有121.6g稀盐酸的烧杯中,刚好完全反应后,烧杯内物质的总质量为128.4g。我能计算:
(1)原混合物中铁粉的质量;
(2)反应后所得溶液中溶质的质量分数。
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
实验室用氯酸钾和二氧化锰制取氧气,加热一段时间后剩余固体混合物10g,继续加热至完全反应后(固体质量不再变化时)固体变为9.04g,再将固体加水充分溶解、过滤、干燥得到1.59g黑色固体。求10g剩余固体混合物中氯元素的质量分数为
| A.7.1% | B.35.5% | C.28.4% | D.42.6% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com