
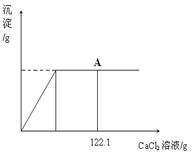
(3分) 向盛有32.9g碳酸钠和氯化钠固体混合物的烧杯中逐滴加入CaCl2溶液,生成沉淀的质量与滴入CaCl2溶液的质量关系如下图所示。反应结束后,A点时溶液中氯化钠溶质的质量分数为26%。(已知:Na2CO3+CaCl2=CaCO3↓+2NaCl)请计算:
(1)原固体混合物中碳酸钠的质量分数。
(2)原固体混合物中钠元素和氯元素的质量比。
(1)64.4% (2)138: 71
【解析】
试题分析:(1)分析本题中所发生的反应为碳酸钠和氯化钙的反应,氯化钠不反应,同时分析图象可知,当沉淀量不再改变时,二者恰好完全反应;则A点时的溶液的溶质是氯化钠(包括原混合物中的氯化钠和反应生成的氯化钠)和过量的CaCl2,已知A点时溶液中氯化钠溶质的质量分数为26%,故可根据溶质质量分数的公式计算。
解:设原固体混合物中碳酸钠的质量为X 。
Na2CO3+CaCl2=CaCO3↓+2NaCl
106 100 117
X
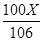
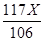
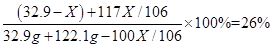
解得,X = 21.2g
碳酸钠的质量分数=(21.2g/32.9g)×100%=64.4%
(2)原混合物固体中含有碳酸钠和氯化钠,故其中钠元素和氯元素的质量比=碳酸钠中的钠元素和氯化钠中的钠元素的质量之和:氯化钠中氯元素的质量
原混合物固体中氯化钠的质量=(32.9-21.2)g =11.7g
钠元素与氯元素的质量比=(21.2×46/106+11.7×23/58.5)g:(11.7×35.5/58.5)g
= (9.2+4.6)g: 7.1g=13.8g: 7.1g=138:71
答:原固体混合物中碳酸钠的质量分数为64.4%;原混合物固体中钠元素和氯元素的质量比为138: 71。
考点:含杂质物质的化学反应的有关计算,根据化学反应方程式的计算
点评:本题为根据化学方程式的基本计算,正确的化学方程式是进行计算的基础,规范的书写格式、准确的计算结果则是考试中不失分的关键。


科目:初中化学 来源: 题型:
 (7分)小亮在实验室发现一瓶盛有无色溶液的试剂瓶,其标签破损,从残余部分只能看出溶质质量分数为10%.老师说,这瓶溶液可能是氢氧化钠、氯化钠、氢氧化钙或是碳酸钠中的一种.
(7分)小亮在实验室发现一瓶盛有无色溶液的试剂瓶,其标签破损,从残余部分只能看出溶质质量分数为10%.老师说,这瓶溶液可能是氢氧化钠、氯化钠、氢氧化钙或是碳酸钠中的一种.| 加入盐酸的体积(V)/mL | 2 | 4 | 6 | 8 | 10 | 12 | 14 | 16 | 18 | 20 |
| 溶液温度 (t)/℃ |
25.2 | 29.6 | 32.0 | 36.0 | 38.2 | 36.7 | 35.7 | 34.7 | 33.7 | 32.9 |
查看答案和解析>>
科目:初中化学 来源: 题型:
(5分)下表列出了固体物质A在不同温度时的溶解度:
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 |
| 溶解废/g | 36 | 35 | 34 | 33 | 32 | 31 | 30 | 29 | 28 | 27 |
(1)70℃时,向盛有100g水的烧杯中加入30g固体A,充分溶解形成的是 (填“饱和”或“不饱和”)溶液,再将烧杯内物质温度降至20℃,此时溶液中溶质与溶剂的质量比为 (填最简整数比);
(2)通过对上表数据的分析,物质A的溶解度曲线应是右图中的 (填 “甲”或“乙”);
(3)80℃时,将甲物质的不饱和溶液变为饱和溶液,可采取的方法是 。(填三种方法)
(4)80℃时,配制一定量甲物质的溶液,将其降温到60℃,是否有固体析出? (填“有”、“没有”或“不确定”)。
查看答案和解析>>
科目:初中化学 来源:2010届北京市昌平区中考二模化学试卷(带解析) 题型:计算题
(3分) 向盛有32.9g碳酸钠和氯化钠固体混合物的烧杯中逐滴加入CaCl2溶液,生成沉淀的质量与滴入CaCl2溶液的质量关系如下图所示。反应结束后,A点时溶液中氯化钠溶质的质量分数为26%。(已知:Na2CO3+CaCl2=CaCO3↓+2NaCl)请计算: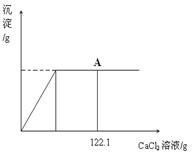
(1)原固体混合物中碳酸钠的质量分数。
(2)原固体混合物中钠元素和氯元素的质量比。
查看答案和解析>>
科目:初中化学 来源:2011-2012学年北京市门头沟区九年级上学期期末考试化学试卷 题型:填空题
(5分)下表列出了固体物质A在不同温度时的溶解度:
|
温度/℃ |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
90 |
|
溶解废/g |
36 |
35 |
34 |
33 |
32 |
31 |
30 |
29 |
28 |
27 |
(1)70℃时,向盛有100g水的烧杯中加入30g固体A,充分溶解形成的是 (填“饱和”或“不饱和”)溶液,再将烧杯内物质温度降至20℃,此时溶液中溶质与溶剂的质量比为 (填最简整数比);
(2)通过对上表数据的分析,物质A的溶解度曲线应是右图中的 (填 “甲”或“乙”);

(3)80℃时,将甲物质的不饱和溶液变为饱和溶液,可采取的方法是 。(填三种方法)
(4)80℃时,配制一定量甲物质的溶液,将其降温到60℃,是否有固体析出? (填“有”、“没有”或“不确定”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com