
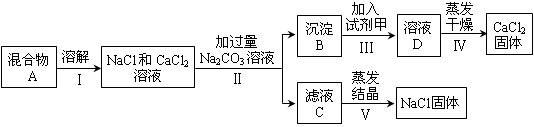


科目:初中化学 来源:不详 题型:单选题
| A.碱能使紫色石蕊试液变蓝,紫色石蕊试液中通入NH3后变蓝,故NH3是碱 |
| B.复分解反应是由两种化合物生成两种化合物,所以由两种化合物生成两种化合物的反应都是复分解反应 |
| C.酸溶液的pH小于7,故pH小于7的溶液都是酸溶液 |
| D.浓盐酸有挥发性,揭开瓶盖瓶口冒白雾;浓硝酸也有挥发性,揭开瓶盖瓶口也会冒白雾 |
查看答案和解析>>
科目:初中化学 来源:不详 题型:填空题

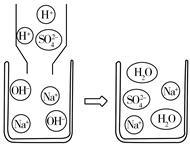
| A.Na2CO3 | B.HCl | C.CuSO4 | D.NaCl |
查看答案和解析>>
科目:初中化学 来源:不详 题型:单选题
| A.大于0.1 mol | B.小于0.1 mol |
| C.0.1 mol | D.0.05 mol |
查看答案和解析>>
科目:初中化学 来源:不详 题型:实验题
| 实验操作 | 测定结果 | 溶液成分 |
| ①用pH试纸测定反应后溶液的酸碱度,操作方法是 。 | ②若pH>7 | |
| ③若 | NaCl |
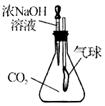
查看答案和解析>>
科目:初中化学 来源:不详 题型:推断题
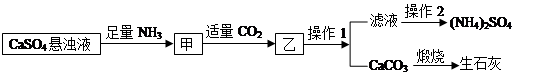
| A.操作1、操作2均为过滤 |
| B.整个流程的总反应的方程式为:CaSO4 +2NH3 +CO2 +H2O=(NH4)2SO4 +CaCO3↓ |
| C.该流程中CO2可被循环使用 |
| D.此过程中若先通CO2后通NH3能提高生产效率 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com