
分析 【提出问题】根据猜想可知要探究的问题是这包久置的碱石灰样品的成分是什么进行解答;
【提出猜想】氧化钙和水反应生成氢氧化钙,氢氧化钙易吸收空气中二氧化碳生成碳酸钙,二氧化碳和氢氧化钠反应生成碳酸钠和水由此解答;
【实验探究】①根据氧化钙和水反应生成氢氧化钙,且放出大量的热,氢氧化钠固体溶解也会放出大量热;氢氧化钙和碳酸钠溶液反应生成碳酸钙沉淀和氢氧化钠进行解答;
【解释与结论】①根据碳酸钠溶液能和氯化钡溶液反应生成碳酸钡沉淀和氯化钠,氢氧化钠溶液呈碱性,能使酚酞试液变红进行解答;
②根据氢氧化钠溶液呈碱性,能使酚酞试液变红以及氯化钡溶液过量进行解答;
【迁移应用】根据能和碱石灰反应的气体不能用碱石灰干燥进行解答.
解答 解:【提出问题】根据猜想可知要探究的问题是这包久置的碱石灰样品的成分是什么;故填:这包久置的碱石灰样品的成分是什么;
【提出猜想】氧化钙和水反应生成氢氧化钙,氢氧化钙易吸收空气中二氧化碳生成碳酸钙,二氧化碳和氢氧化钠反应生成碳酸钠和水,所以该碱石灰的主要成分可能含有CaO、Ca(OH)2、CaCO3、NaOH和Na2CO3;故填:Na2CO3;
【实验探究】①氧化钙和水反应生成氢氧化钙,且放出大量的热,氢氧化钠固体溶解也会放出大量热,所以加少量水后无放热现象,说明这包碱石灰样品中不含氧化钙和氢氧化钠;氢氧化钙和碳酸钠反应生成碳酸钙沉淀和氢氧化钠,所以不一定含有碳酸钙,化学方程式为Ca(OH)2+Na2CO3═CaCO3↓+2NaOH;故填:CaO、NaOH;Ca(OH)2+Na2CO3═CaCO3↓+2NaOH;
【解释与结论】①碳酸钠溶液能和氯化钡溶液反应生成碳酸钡沉淀和氯化钠,所以取少量上层清液于另一试管中,向其中滴加过量BaCl2溶液,有白色沉淀生成,说明一定含有碳酸钠;②过滤后所得物质能使酚酞试液变红,说明有氢氧化钠(此时溶液中不可能有氢氧化钙,因为有碳酸钠),又因为原固体混合物中没有NaOH,所以应该是Ca(OH)2和Na2CO3反应生成了NaOH,因此固体混合物中一定有Ca(OH)2;
故填:Na2CO3、Ca(OH)2;CaCO3;
②氢氧化钠溶液呈碱性,能使酚酞试液变红以及氯化钡溶液过量,所以③所得溶液中除酚酞外还含有的溶质是氢氧化钠、氯化钠和氯化钡;故填:NaOH、NaCl、BaCl2;故填:NaOH、NaCl、BaCl2;
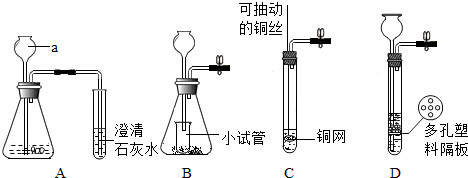
【迁移应用】能和碱石灰反应的气体不能用碱石灰干燥,其中氯化氢和二氧化硫能和氢氧化钠,所以不能用碱石灰干燥.故选:C.
故答案为:
【提出问题】这包久置的碱石灰样品的成分是什么?;
【提出猜想】Na2CO3;
【实验探究】①CaO、NaOH; Ca(OH)2+Na2CO3=2NaOH+CaCO3↓;
【解释与结论】①Na2CO3、Ca(OH)2;CaCO3;
②NaCl、NaOH、BaCl2;
【迁移应用】C.
点评 本题是以生活中常见的食品干燥剂为情境角度出发,判断干燥剂是否变质的实验探究的综合性推断题,考查了CO2、NaOH、Ca(OH )2、CaCO3 之间如何相互转化,特别是考查学生在实验探究中推断分析能力和平时对含碳的化合物的化学性质的积累,通过该实验探究结果引发学生在化学实验室中氢氧化钙如何正确保存,做到学以致用.


 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:多选题
 如图是甲、乙、丙三种固体物质(均不含结晶水)的溶解度曲线.下列说法正确的是( )
如图是甲、乙、丙三种固体物质(均不含结晶水)的溶解度曲线.下列说法正确的是( )| A. | t1℃时甲、丙物质溶液中溶质质量分数一定相等 | |
| B. | 将t2℃时甲、乙、丙三种物质的饱和溶液分别降温至t1℃,所得溶液的溶质质量分数:乙>甲>丙 | |
| C. | t2℃时甲、乙、丙的饱和溶液分别恒温蒸发等量的水,析出溶质的质量:甲>乙>丙 | |
| D. | 若使点a的甲溶液60g,转化到点b,至少应加入30g甲固体 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 食品包装中常使用一种袋装为“504双吸剂”防腐剂,标签如图所示.作用:防潮、防氧化.双吸剂变质失效后,固体中大部分是灰白色的,少许是红棕色的.甲、乙、丙三位同学对一包久置的“双吸剂”的变质情况进行探究.
食品包装中常使用一种袋装为“504双吸剂”防腐剂,标签如图所示.作用:防潮、防氧化.双吸剂变质失效后,固体中大部分是灰白色的,少许是红棕色的.甲、乙、丙三位同学对一包久置的“双吸剂”的变质情况进行探究.| 实验操作 | 实验现象 | 实验结论 |
| 甲:取少量固体放于试管中,加足量蒸馏水溶解,静置后取上层清液滴加无色酚酞溶液 | 固体溶解时触摸试管外壁,感觉发烫,试管底部有不溶物,溶液变红色. | 甲:固体中一定含有CaO和Ca(OH)2 |
| 乙:另取少量固体放于试管中,滴加足量的稀盐酸 | 固体逐渐消失,有大量无色气体产生,得到浅绿色溶液 | 乙:固体中一定含有铁,一定不含有Fe2O3 |
| 丙:将乙产生的气体通入到澄清石灰水中 | 澄清石灰水中变浑浊 | 丙:固体中一定含有CaCO3 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| Fe3O4 | Fe2O3 | 铁 | |
| 分解温度/℃ | 1538 | 1400 | - |
| 熔点/℃ | - | - | 1535 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验一 观察固体表面 | 实验二 向两块固体表面滴加稀盐酸 | 实验三 振荡3个塑料瓶 |
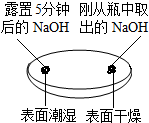 | 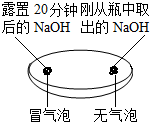 | 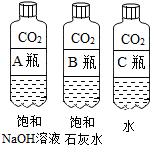 |
| 实验一 | 实验二 | 分析 |
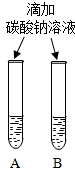 | 微热(不考虑水分蒸发)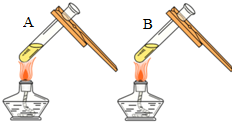 | 两种方案中均观察到A试管内出现白色浑浊,则A中溶液为饱和氢氧化钙溶液;;方案二的设计原理是氢氧化钙的溶解度随温度升高而减小,氢氧化钠的溶解度随温度升高而增大. |

查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 选项 | A | B | C | D |
| 实验项目 | 除去KCl中少量的MnO2 | 用10mol/L的盐酸配制100mL0.1mol/L的盐酸 | 用氯化钠溶液制备氯化钠晶体 | 除去CO2气体中的HCl |
| 实验仪器 或装置 | 烧杯、玻璃棒、分液漏斗 | 100mL容量瓶、玻璃棒、烧杯 | 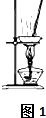 | 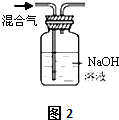 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com