
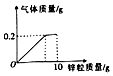
 向盛有100g稀硫酸的烧杯中逐渐加入10g锌粒,产生气体质量与锌粒质量的关系如图所示.请根据关系图分析并计算:
向盛有100g稀硫酸的烧杯中逐渐加入10g锌粒,产生气体质量与锌粒质量的关系如图所示.请根据关系图分析并计算:分析 化合物中元素化合价代数和为零;
锌和稀硫酸反应生成硫酸锌和氢气,根据反应的化学方程式及其提供的数据可以进行相关方面的计算.
解答 解:(1)设硫酸中硫元素的化合价为x,
硫酸中氢元素化合价是+1,氧元素化合价是-2,根据题意有:(+1)×2+x+(-2)×4=0,
x=+6,
故填:+6.
(2)设硫酸质量为y,
Zn+H2SO4═ZnSO4+H2↑,
98 2
y 0.2g
$\frac{98}{y}$=$\frac{2}{0.2g}$,
y=9.8g,
该稀硫酸中溶质的质量分数为:$\frac{9.8g}{100g}$×100%=9.8%,
答:该稀硫酸中溶质的质量分数为9.8%.
点评 本题主要考查学生运用假设法和化学方程式进行计算和推断的能力,计算时要注意规范性和准确性.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:初中化学 来源: 题型:计算题
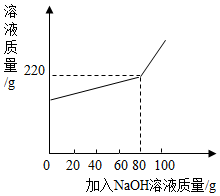 将一定量氯化镁和氯化钠的固体混合物加水配成145.8g的溶液,向所得溶液中加入一定浓度的氢氧化钠溶液,加入氢氧化钠溶液的质量与反应后溶液的质量关系如图.计算:
将一定量氯化镁和氯化钠的固体混合物加水配成145.8g的溶液,向所得溶液中加入一定浓度的氢氧化钠溶液,加入氢氧化钠溶液的质量与反应后溶液的质量关系如图.计算:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 氯化钠用于配制生理盐水 | B. | 干冰用于人工降雨 | ||
| C. | 氢氧化铝用于治疗胃酸过多 | D. | 氢氧化钠用作食品干燥剂 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 实验操作 | 实验现象 | 实验结论 |
| 取一定量纯碱样品配成溶液后,滴加过量的CaCl2溶液. | 产生白色沉淀 | 反应的化学方程式: Na2CO3+CaCl2═CaCO3↓+2NaCl |
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
 如图表示某些物质间的转化关系(反应条件和部分产物已省略).常温下A、C是由相同元素组成的无色液体,且C是一种最常用的溶剂;D、I、J均为无色气体,其中I能使澄清石灰水变浑浊;K为红棕色粉末.请回答下列问题:
如图表示某些物质间的转化关系(反应条件和部分产物已省略).常温下A、C是由相同元素组成的无色液体,且C是一种最常用的溶剂;D、I、J均为无色气体,其中I能使澄清石灰水变浑浊;K为红棕色粉末.请回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | HgO2$\frac{\underline{\;\;△\;\;}}{\;}$Hg+O2↑ | B. | Al+2HCl═AlCl3+H2↑ | ||
| C. | Cu+FeSO4═CuSO4+Fe | D. | 2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑ |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com