
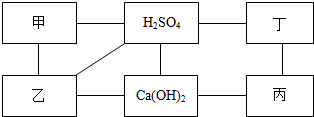
 如图中每条直线两端的物质在一定条件下都可以发生化学反应,其中甲、乙、丙、丁分别为Mg、BaCl2、Na2CO3、盐酸四种物质中的一种.
如图中每条直线两端的物质在一定条件下都可以发生化学反应,其中甲、乙、丙、丁分别为Mg、BaCl2、Na2CO3、盐酸四种物质中的一种.分析 氯化钡能和稀硫酸反应生成硫酸钡沉淀和盐酸,能和碳酸钠反应生成碳酸钡沉淀和氯化钠;
碳酸钠能和稀硫酸反应生成硫酸钠、水和二氧化碳,能和氢氧化钙反应生成碳酸钙和氢氧化钠;
镁能和稀硫酸反应生成硫酸镁和氢气,能和稀盐酸反应生成氯化镁和氢气,稀盐酸能和氢氧化钙反应生成氯化钙和水.
解答 解:氯化钡能和稀硫酸反应生成硫酸钡沉淀和盐酸,能和碳酸钠反应生成碳酸钡沉淀和氯化钠;
碳酸钠能和稀硫酸反应生成硫酸钠、水和二氧化碳,能和氢氧化钙反应生成碳酸钙和氢氧化钠;
镁能和稀硫酸反应生成硫酸镁和氢气,能和稀盐酸反应生成氯化镁和氢气,稀盐酸能和氢氧化钙反应生成氯化钙和水,因此甲、乙、丙、丁分别为氯化钡、碳酸钠、稀盐酸和镁;
(1)甲是BaCl2,乙是Na2CO3.
故填:BaCl2;Na2CO3.
(2)碳酸钠和氢氧化钙反应的化学方程式为:Na2CO3+Ca(OH)2═CaCO3↓+2NaOH;
镁和稀盐酸反应的化学方程式为:Mg+2HCl═MgCl2+H2↑.
故填:Na2CO3+Ca(OH)2═CaCO3↓+2NaOH;Mg+2HCl═MgCl2+H2↑.
(3)氯化钡能和稀硫酸反应生成硫酸钡沉淀和盐酸,属于复分解反应.
故填:复分解.
点评 本题主要考查物质的性质,解答时要根据各种物质的性质,结合各方面条件进行分析、判断,从而得出正确的结论.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:初中化学 来源: 题型:解答题
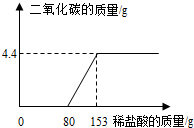 某工厂排放的废水中含有NaOH和Na2CO3,为了测定废水中NaOH的质量分数,取废水100g逐滴加入稀盐酸至过量,测得生成气体的质量与所加稀盐酸的质量关系如图所示.试计算:
某工厂排放的废水中含有NaOH和Na2CO3,为了测定废水中NaOH的质量分数,取废水100g逐滴加入稀盐酸至过量,测得生成气体的质量与所加稀盐酸的质量关系如图所示.试计算:查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
 使用密度小、强度大的镁合金能减轻汽车自重,从而减少汽油消耗和废气排放.
使用密度小、强度大的镁合金能减轻汽车自重,从而减少汽油消耗和废气排放.查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 硝酸钾在农业上,可做复合肥使用 | B. | 火药是化合物 | ||
| C. | 硝酸钾属于盐类化合物 | D. | 硝酸钾属于易溶物 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com