将18克碳单质在57克氧气中完全燃烧,生成CO2 ________克;剩余的物质是 ________,质量为 ________克;将燃烧时生成的气体通入足量的澄清石灰水中,可生成白色沉淀 ________克.
66 氧气 9 150
分析:①根据碳在氧气中燃烧的化学方程式C+O
2
CO
2可知,碳与氧气的相对分子质量比为3:4,分析题意可知,氧气有剩余.利用化学方程式和碳的质量,就可计算出生成二氧化碳的质量;然后根据质量守恒定律,求出参与反应的氧气质量,进而计算出剩余氧气的质量;
②石灰水是氢氧化钙,利用二氧化碳与氢氧化钙反应的化学方程式,就可计算出生成沉淀的质量.
解答:①设生成二氧化碳的质量为x,
C+O
2
CO
2
12 44
18g x
∴
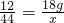
,
解之得:x=66g;
则剩余氧气的质量为:57g-(66g-18g)=9g;
②设生成沉淀的质量为y,
CO
2+Ca(OH)
2=CaCO
3↓+H
2O
44 100
66g y
∴
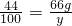
,
解之得:y=150g.
故答案为:66;氧气;9;150.
点评:本题主要考查学生运用化学方程式进行计算的能力.根据化学方程式和碳与氧气的相对分子质量比,可以判断出剩余的物质.然后根据完全反应的物质质量结合化学方程式进行计算,即可顺利答题.

 CO2可知,碳与氧气的相对分子质量比为3:4,分析题意可知,氧气有剩余.利用化学方程式和碳的质量,就可计算出生成二氧化碳的质量;然后根据质量守恒定律,求出参与反应的氧气质量,进而计算出剩余氧气的质量;
CO2可知,碳与氧气的相对分子质量比为3:4,分析题意可知,氧气有剩余.利用化学方程式和碳的质量,就可计算出生成二氧化碳的质量;然后根据质量守恒定律,求出参与反应的氧气质量,进而计算出剩余氧气的质量; CO2
CO2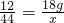 ,
,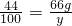 ,
,
