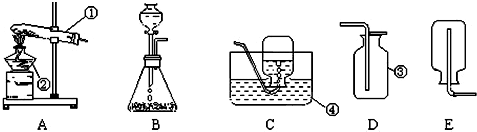
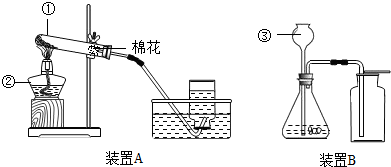
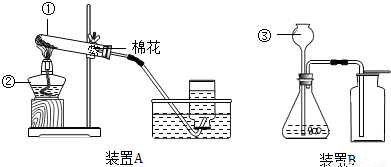
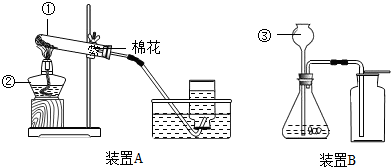
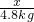解:(1)根据加热高锰酸钾制取氧气时,要在试管口处放上一团松软的棉花,以免高锰酸钾小颗粒进入导气管,堵塞导气管,因此依据装置A的特点,推测其所用的制氧气的方法是b;该反应的化学方程式为:2KMnO
4
K
2MnO
4+MnO
2+O
2↑;用二氧化锰粉末作催化剂使过氧化氢溶液在常温下就能分解产生水和氧气;所以发生装置为“固液常温型”故选装置B;反应方程式为:2H
2O
2
2H
2O+O
2↑;
故答案为:b; 2KMnO
4
K
2MnO
4+MnO
2+O
2↑;B;2H
2O
2
2H
2O+O
2↑;
(2)根据用排水法收集氧气实验操作的注意事项:实验结束时,先把导气管从水槽中取出,再移走酒精灯,防止水倒流入试管底部炸裂试管;根据在“固液常温型”的装置中,长颈漏斗的下端管口应浸在液面下,防止生成的气体从长颈漏斗中逸出;
故答案为:防止水槽中水倒吸,引起试管破;防止生成的气体从长颈漏斗中逸出;
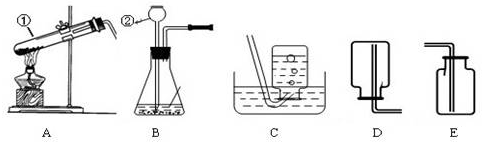
(3)4.8kg氧气在标准状况下的体积为:
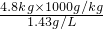
=3356.6L;
设需要高锰酸钾的质量为x,则
2KMnO
4
K
2MnO
4+MnO
2+O
2↑
316 32
x 4.8kg
∴

=
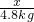
解之得:x=47.4kg;
答:这些氧气在标准状况下的体积是3356.6L;需要高锰酸钾的质量为47.4kg.
分析:(1)根据加热高锰酸钾制取氧气时,不要忘掉在试管口处放上一团松软的棉花,以免高锰酸钾小颗粒进入导气管,堵塞导气管进行分析装置图;根据书写化学方程式的步骤:写配注等,正确写出反应方程式即可;用二氧化锰粉末作催化剂使过氧化氢溶液在常温下就能分解产生水和氧气,发生装置为“固液常温型”;根据书写化学方程式的步骤书写;
(2)根据用排水法收集氧气实验操作的注意事项:实验结束时,先把导气管从水槽中取出,再移走酒精灯,防止水倒流入试管底部炸裂试管解答;根据在“固液常温型”的装置中,长颈漏斗的下端管口应浸在液面下,防止生成的气体从长颈漏斗中逸出;
(3)根据密度公式进行计算即可;根据高锰酸钾分解的化学方程式和所需氧气的质量,列出比例式,就可计算出需要高锰酸钾的质量.
点评:熟记氧气的实验室制取原理和氧气的溶解性、密度等;熟悉常见仪器的用途、基本的实验操作及注意事项等等,方能正确解答.

 K2MnO4+MnO2+O2↑;用二氧化锰粉末作催化剂使过氧化氢溶液在常温下就能分解产生水和氧气;所以发生装置为“固液常温型”故选装置B;反应方程式为:2H2O2
K2MnO4+MnO2+O2↑;用二氧化锰粉末作催化剂使过氧化氢溶液在常温下就能分解产生水和氧气;所以发生装置为“固液常温型”故选装置B;反应方程式为:2H2O2 2H2O+O2↑;
2H2O+O2↑; K2MnO4+MnO2+O2↑;B;2H2O2
K2MnO4+MnO2+O2↑;B;2H2O2 2H2O+O2↑;
2H2O+O2↑;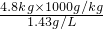 =3356.6L;
=3356.6L; K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑ =
=