
【题目】下图为某同学所做的实验及现象:
(1)实验一中发生两个反应,写出化学方程式、。
(2)实验二中出现浅绿色固体。该同学对浅绿色固体的成分作以下探究。
【查阅资料】
① NaOH与CuSO4反应会生成碱式硫酸铜[Cu4(OH)6SO4],其不溶于水,能与酸反应;
② Cu(OH)2分解温度为80℃,Cu4(OH)6SO4分解温度为300℃。
【猜想与假设】
①浅绿色固体为Cu4(OH)6SO4;
②浅绿色固体为Cu4(OH)6SO4和Cu(OH)2的混合物。
【实验验证】
① 将实验二的试管加热至100℃,出现黑色固体,则证明浅绿色固体中含有 。
② 从实验二加热后的试管中分离出固体时,证明固体已洗涤干净的方法是。
③ 将②中所得固体溶于足量(选填序号),再滴加Ba(NO3)2溶液,出现白色沉淀。
A.盐酸 B.稀硝酸 C.稀硫酸
(3)【结论】猜想②正确。
【拓展与思考】
若将实验二中的浅绿色固体浸泡在过量的NaOH溶液中,密封放置一天后,固体全部变为蓝色。写出此反应的化学方程式 。
【答案】
(1)2NaOH + CuSO4 = Cu(OH)2↓ + Na2SO4,Cu(OH)2 ![]() CuO+H2O
CuO+H2O
(2)Cu(OH)2,最后一次洗涤液,滴加BaCl2溶液,没有沉淀产生,说明已洗涤干净,AB
(3)Cu4(OH)6SO4+2NaOH=4Cu(OH)2↓+Na2SO4
【解析】解:(1)氢氧化钠和硫酸铜反应生成氢氧化铜沉淀和硫酸钠,反应方程式为:2NaOH+CuSO4=Cu(OH)2↓+Na2SO4,氢氧化铜在加热条件下分解生成氧化铜和水,反应方程式为:Cu(OH)2 ![]() CuO+H2O;(2)氢氧化铜受热分解为黑色的氧化铜和水,Cu(OH)2分解温度为80℃,试管加热至100℃,出现黑色固体,则证明浅绿色固体中含有Cu(OH)2;固体已洗涤干净则表面不含硫酸钠溶液,可以取最后一次洗涤液,滴加BaCl2[或Ba(NO3)2、Ba(OH)2]溶液,无沉淀生成,则固体已洗净;碱式硫酸铜[Cu4(OH)6SO4],其不溶于水,能与酸反应;并且要验证有硫酸根离子,所以不能引入硫酸根离子,故用盐酸或稀硝酸都可以;(3)Cu4(OH)6SO4可以进一步与氢氧化钠反应生成氢氧化铜和硫酸钠,方程式为Cu4(OH)6SO4+2NaOH=4Cu(OH)2↓+Na2SO4。
CuO+H2O;(2)氢氧化铜受热分解为黑色的氧化铜和水,Cu(OH)2分解温度为80℃,试管加热至100℃,出现黑色固体,则证明浅绿色固体中含有Cu(OH)2;固体已洗涤干净则表面不含硫酸钠溶液,可以取最后一次洗涤液,滴加BaCl2[或Ba(NO3)2、Ba(OH)2]溶液,无沉淀生成,则固体已洗净;碱式硫酸铜[Cu4(OH)6SO4],其不溶于水,能与酸反应;并且要验证有硫酸根离子,所以不能引入硫酸根离子,故用盐酸或稀硝酸都可以;(3)Cu4(OH)6SO4可以进一步与氢氧化钠反应生成氢氧化铜和硫酸钠,方程式为Cu4(OH)6SO4+2NaOH=4Cu(OH)2↓+Na2SO4。
【考点精析】认真审题,首先需要了解书写化学方程式、文字表达式、电离方程式(注意:a、配平 b、条件 c、箭号).


科目:初中化学 来源: 题型:
【题目】维生素C (C6H8O6)对人体皮肤和牙龈健康有重要作用,缺乏维生素C会引起坏血病,中学生每天需要补充约60mg维生素C。请回答下列问题: (写出计算过程)
(1)维生素C中碳、氧元素的质量比是___________。
(2)维生素C的相对分子质量是________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】在实验课上,同学们将CO2通入到Ca(OH)2溶液中观察到有白色沉淀生成,而将CO2通入到NaOH溶液中无明显现象。
【提出问题】CO2与NaOH溶液是否发生了化学反应?
【提出猜想】CO2与NaOH溶液发生了化学反应
【实验探究】小明设计出了下列4种实验装置,其共同原理是二氧化碳和氢氧化钠溶液反应,使容器内压强降低。
(1)实验现象为:A中试管内液面上升,B中 , C中 , D中水槽中的水部分进入烧瓶。
(2)小宁对小明的方案提出了质疑,他认为小明的实验不严谨,其理由是要得到科学严谨的结论,利用方案A,补做的对比实验是。
(3)小丽的改进方案是利用反应后的溶液来验证猜想,请完成实验报告。
实验操作 | 实验现象 | 实验结论 |
向实验后的溶液中加入稀盐酸 | 猜想正确 |
(4)【得出结论】CO2与NaOH溶液发生了化学反应,请写出CO2与NaOH反应的化学方程式:。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】铁、铜是我们生活中重要的金属材料。
(1)电路中经常用铜作导线,这是利用了铜的_______性。
(2)工业上用一氧化碳和赤铁矿(主要成分是氧化铁)冶炼铁,发生的化学方程式是______________
(3)将油漆涂在铁艺家具上以防止生锈,其目的是将铁与空气中的______、_______隔绝。
(4)矿物的储量有限,而且不可再生。我们需要保护金属资源并进行金属的回收利用。欲从含有硫酸、硫酸亚铁和硫酸铜的废液中,回收全部铜。处理过程如下:步骤①加入过量铁粉,写出发生反应的其中一个化学方程式____________________________ 该反应的基本反应类型是_________ 反应,充分反应后步骤②进行的操作是__________,得到的滤渣中含有_______ ,继续处理可以得到纯净的金属铜和硫酸亚铁固体。
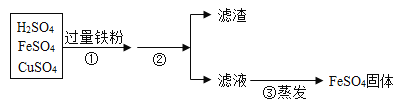
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】铝是地壳中含量极丰富的金属元素,在生产生活中有着重要的用途有着重要的用途。现代电解铝工业生产采用冰晶石-氧化铝融盐电解法,即电解氧化铝。氧化铝在通电的条件下分解生成铝和另一种非金属单质。现有含氧化铝80%的铝土矿85t,理论上能冶炼出多少金属铝?
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】水是生命之源,“珍惜水、节约水、保护水”是每个公民的义务和责任.
(1)下列“水”属于纯净物的是____________(填标号)
A.蒸馏水 B.河水 C.自来水
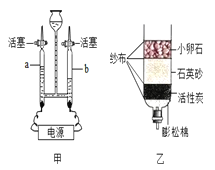
(2)用上图中的甲装置进行电解水的实验,写出该反应的化学方程式_________________。
(3)某同学自制如图7中乙所示简易净水器,其中活性炭的主要作用是 _____________。
(4)人们常用_________检验地下水是硬水还是软水的硬度。
(5)高铁酸钾(K2FeO4)是一种新型、高效的多功能水处理剂。高铁酸钾(K2FeO4)中铁元素的化合价是__________。
(6)请举一例生活中节约用水的具体措施 ______________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】锌是人体必需的的微量元素,称“生命元素”。
(1)【锌的广泛应用】
处于生长发育期的儿童、青少年如果缺锌,会导致发育不良,食欲差,反应迟钝。缺乏严重时,将会导致“ 症”和智力发育不良。 补“锌”采用药补与食补并举,经常吃贝壳类海产品、红色肉类等含锌的食物有利补“锌”,这个“锌 ”指。
A. 单质 B. 元素 C. 原子 D. 分子
(2)实验室用锌与稀硫酸制取氢气,同时得到副产品硫酸锌。反应的化学方程式为。
(3)【制备七水硫酸锌】
以含锌废渣(主要成分为ZnO,杂质为FeO﹑CuO)为原料制备七水硫酸锌(ZnSO4·7H2O)的流程如下。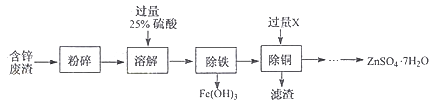
粉碎的目的是。
(4)若实验室用质量分数为98%,密度为1.84g/ml的浓硫酸配制200g、25%的稀硫酸,需要浓硫酸的体积为(精确到小数点后一位),配制时,需要的玻璃仪器有量筒﹑玻璃棒、烧杯和 ,
(5)物质X是 , 滤渣中含有的金属单质有 ,
(6)流程中获得七水硫酸锌前省略的操作是﹑冷却结晶﹑过滤、洗涤和低温烘干。
(7)某温度下,Fe(OH)3分解得到一种铁﹑氧质量比21:8的氧化物,该氧化物的化学式。
(8)除铁过程中,温度、pH对除铁效果的影响分别对如图所示。由图可知,除铁时温度应控制在℃为宜,pH应控制在为宜。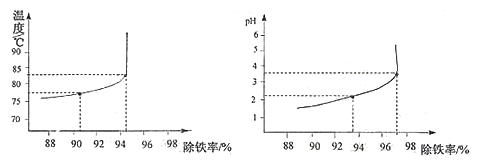
(9)【组成测定】在一定条件下,向ZnSO4溶液中加入Na2CO3溶液,充分反应后,经过滤、洗涤、低温干燥得到纯净滤渣aZnCO3·bZn(OH)2·cH2O。为了确定aZnCO3·bZn(OH)2·cH2O组成,进行如下实验: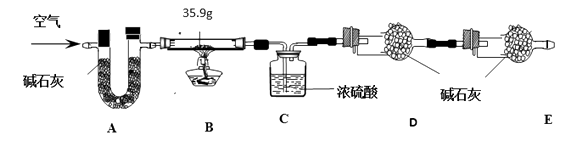
【查阅资料】(假设每步反应、吸收均完全。碱石灰为氢氧化钠和生石灰的混合物。)
aZnCO3·bZn(OH)2·cH2O受热分解生成ZnO、H2O、CO2三种产物,
其中ZnCO3 ![]() ZnO+CO2↑;Zn(OH)2
ZnO+CO2↑;Zn(OH)2 ![]() ZnO+H2O。
ZnO+H2O。
现称取35.9 g aZnCO3·bZn(OH)2·cH2O在B装置中进行煅烧,将完全煅烧过程中产生的气体依次通过装置C和装置D,它们分别增重7.2 g和4.4 g。
【实验分析及数据处理】
装置A的作用是。
(10)若没有E装置,测得二氧化碳的质量(填“偏大”、“偏小”或“无影响”)。
(11)根据上述数据,化学式a ZnCO3·b Zn(OH)2· c H2O中的a:b:c = 。
(12)【反思与拓展】
滤渣成分因温度等不同导致a、b、c会有差异,假设B化学式为ZnCO3·2Zn(OH)2·H2O,向该B中加入稀硫酸,反应的化学方程式为:。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】二氧化氯(ClO2)是一种高效、安全的消毒剂。工业上可采用氯酸钠(NaClO3)为原料制备,下图是工业生产中一种以食盐水为原料制备二氧化氯的工艺原理。
下列说法正确的是( )
A.二氧化氯可用于饮用水的消毒杀菌
B.氯化钠电解槽产生的气体单质为O2和Cl2
C.该流程中氯元素的最高化合价为+4价
D.二氧化氯反应器中的反应为:2NaClO3+4HCl═2ClO2↑+Cl2↑+2NaCl+2X,X为H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com