
【题目】某兴趣小组发现铁钉生锈需要几天的时间,询问老师如何加快铁钉生锈的速度。
老师说氯化物可能加快铁钉生锈的速度。
【提出问题】氯化物对铁钉生锈有怎样的影响?
【查阅资料】
ⅰ.NaCl、CaCl2、CuCl2等由氯离子与金属离子构成的盐属于氯化物。
ⅱ.铜能与氧气反应,生成黑色的CuO。
ⅲ.CuO能与稀硫酸发生反应:CuO + H2SO4 ==== CuSO4 + H2O。
【进行实验、分析解释、获得结论】
实验1:探究氯化物对铁钉生锈速度的影响。
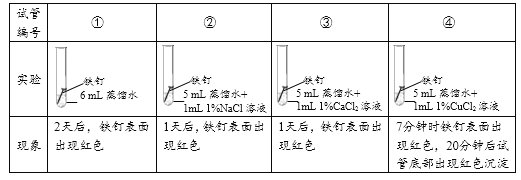
(1)对比实验①②③可以得到的结论是_________。
(2)小组同学认为,试管④中的红色沉淀可能是铁锈,也可能是铜。他们认为红色沉淀可能是铜的理由是__________(用化学方程式解释)。
实验2:探究试管④中红色沉淀的物质组成。
实验步骤 | 实验操作 | 实验现象 |
Ⅰ | 取出试管④中的铁钉,过滤剩余物,洗涤滤纸上的物质 | 固体为红色 |
Ⅱ | 将步骤Ⅰ所得红色固体加入试管中,再向试管中加入足量的___________ | 红色固体大部分溶解,溶液变为黄色 |
Ⅲ | 将步骤Ⅱ所得混合物过滤,洗涤、干燥滤纸上的固体后,置于石棉网上充分加热 | 红色固体变黑 |
Ⅳ | 向试管中加入步骤Ⅲ所得黑色固体,再加入足量稀硫酸 | 黑色固体全部溶解,溶液变为蓝色 |
(3)步骤Ⅱ中所加入的试剂是_________。
(4)步骤Ⅲ、Ⅳ的实验目的是_________。
(5)由实验2可得出结论:试管④中红色沉淀的物质组成是_________。
【反思与评价】
(6)结合实验1、2的结论,对于“氯化物对铁钉生锈速度的影响”,小组同学提出了进一步的假设:__。
【答案】 氯化物能加快铁钉生锈的速率 CuCl2 + Fe FeCl2 + Cu 稀盐酸或稀硫酸 略 检验红色沉淀中是否含有铜 Cu和Fe2O3 当氯化物能与铁钉反应(置换生成金属)时,可能加快铁钉生锈速度(或其它合理答案)
【解析】(1)由题可知,铁在蒸馏水中的生锈速度比在氯化物溶液中的生锈速度慢,故可以说明氯化物能加快铁钉生锈的速率;
(2)铁的活动性比铜强,故铁可能与氯化铜反应,生成红色的铜和氯化亚铁,反应方程式为CuCl2 + Fe FeCl2 + Cu;
(3)向固体中加入某种物质后生成黄色的溶液,说明有三价铁离子生成,故固体应该含有氧化铁,加入的物质为酸,是稀盐酸或稀硫酸
(4)步骤Ⅲ、Ⅳ的实验目的是为了检验红色沉淀中是否含有铜
(5)验2中红色固体大部分溶解,溶液变为黄色,说明溶液中有氧化铁和铜;
(6)题中给的氯化物两种不与铁反应,一种能与铁反应,故可能的假设是当氯化物能与铁钉反应(置换生成金属)时,可能加快铁钉生锈速度。


 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案科目:初中化学 来源: 题型:
【题目】硫酸铜是一种应用极其广泛的化工原料,易溶于水而不易溶于酒精;铜离子完全沉淀的pH是5左右,铁离子完全沉淀的pH是2左右。以下是某工厂用含铁废铜为原料生产胆矾(CuSO4·5H2O)和副产物石膏(CaSO4·2H2O)的生产流程示意图:

胆矾和石膏在不同温度下的溶解度(g/100g水)如表。
温度(℃) | 20 | 40 | 60 | 80 | 100 |
石膏 | 0.32 | 0.26 | 0.15 | 0.11 | 0.07 |
胆矾 | 32 | 44.6 | 61.8 | 83.8 | 114 |
请回答下列问题:
(1)红褐色滤渣的主要成分是____________;
(2)铜和稀硝酸反应的化学方程式3Cu+8HNO3=_____________+2NO↑+4H2O;
(3)石灰浆调pH大约要调节到___________
A. 2 B. 5 C. 7 D. 10
(4)操作I最后温度应该控制在___________℃左右;
(5)从溶液中分离出硫酸铜晶体的操作Ⅱ应为蒸发浓缩、_______、过滤、洗涤、干燥;晶体用无水乙醇作洗涤液而不用蒸馏水的原因是__________________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】核电荷数为1~18的元素的原子结构示意图等信息如下,回答下列问题:

(1)在第三周期中,各原子结构的共同之处是 ;该周期中,各原子核外电子排布的变化规律是 .
(2)在第三周期中,元素类型的变化情况是:从左到右由 元素过渡到 元素,并以 元素结尾.
(3)写出核外电子排布与氖原子相同的阳离子和阴离子符号各一个:
阳离子 ;阴离子 .
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】天气渐暖,春色宜人,某校举行了一场气势宏大的运动会,赛场上同学们沉着应对,稳健发挥,赛出了水平,赛出了友谊。
(1)运动会上的下列用品,主要含有合成有机高分子材料的是________。
A.橡胶跑道 B.纯棉运动服 C.铅球 D.塑料座椅
(2)早晨,学校食堂为同学们准备了以下早餐:炒青菜、鸡蛋、大米粥、馒头,其中蛋白质含量最高的是_____________。
(3)准备比赛用品时,刘翔同学发现铁质的起跑器生锈了,他想用稀盐酸来除铁锈,请写出反应方程式_____________________________________。
(4)比赛中,裁判员高举发令枪,枪声一响,立即产生了大量的白烟,已知枪中火药的主要成分是一种暗红色固体,请画出组成该固体的元素的原子结构示意图_________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】NSR技术通过BaO和Ba(NO3)2的相互转化实现NOx(氮氧化物)的储存和还原,能有效降低柴油发动机在空气过量条件下的NOx排放。其工作原理如下图所示。
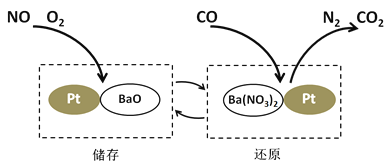
(1)储存时,部分NO和O2在一定条件下发生化合反应生成NO2,该反应的化学方程式为___________;吸收NOx(如NO、NO2)的物质是___________。
(2)还原时,存在如下反应:
5CO + Ba(NO3)2![]() N2 + BaO + 5CO2
N2 + BaO + 5CO2
①反应中,碳元素的化合价__________(填“升高”或“降低”)。
②若有28 g CO参与反应,则生成CO2的质量为________g。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列图像能正确反映其对应操作中某物质质量变化关系的是

A.将生锈铁钉放入过量的稀盐酸
B.将一定质量的红磷放在盛有氧气的密闭容器中燃烧
C.将等质量的镁和铝分别放入足量的稀硫酸中
D.向氢氧化钠和氯化钡的混合溶液中滴加过量的稀硫酸
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】电动平衡车是一种新型的交通工具。如图为一款电动平衡车的示意图。

(1)所标物质中,属于有机合成材料的是___________ (填一种即可,下同),属于金属材料的是___________。
(2)合金与纯金属相比,优点是 ___________;写出能表示铝和铁的金属活动性强弱的化学方程式___________________。
(3)电动平衡车是现代人用来作为代步工具、休闲娱乐的一种新型的绿色环保的产物。由此你对化学与人类生活的关系有何感想?_________________________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(1)“对比”是一种重要的实验探究手段,通过“对比”可以判断是否发生反应,反应的速率、反应的条件等。请回答下列问题:
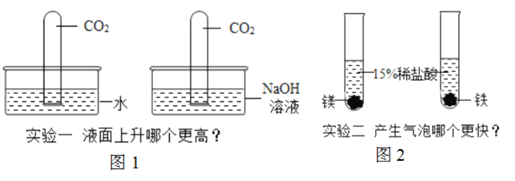
①写出实验一中液面“更高”的化学方程式:_________________________。
②根据实验二的现象从而得出活动性Mg_______Fe。
(2)实验三所示是酸碱中和反应的实验研究:
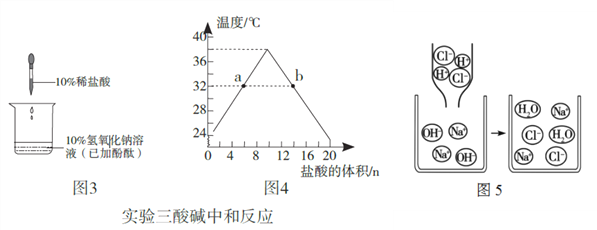
①滴加稀盐酸前,烧杯中溶液呈______色。随着稀盐酸不断滴入溶液呈无色,为探究反应后稀盐酸是否过量,可选用的试剂有_____________。(填选项,多选)
A.Ca(OH)2 B.锌粒 C.鸡蛋壳 D.紫色石蕊溶液 E.铜丝
②随着盐酸不断滴入,烧杯中溶液的pH逐渐______。(填“增大”、“减小”或“不变”)
③随着盐酸不断滴入,烧杯中溶液温度变化如坐标图4所示。根据图象可以判断中和反应是______反应(填“放热”或“吸热”)。
④图5是NaOH和稀HCl反应的示意图,用化学反应方程式表示为_____________,从该图可以看出,反应前后微粒数目减少的有_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com