
【题目】如图是甲、乙两种物质的溶解度曲线,请回答:

① M点的意义是_________________
② t2℃时,将40g的甲物质放入盛有50g水的烧杯中,所得溶液为____________(填“饱和”或“不饱和”)溶液,此时溶质的质量分数为____________。
③ 从甲溶液中提纯甲的方法是_________________;
④ 加热乙的饱和溶液出现浑浊,原因是__________________________________;
⑤现有t2℃甲的饱和溶液,与该溶液有关的量由:
A水的质量 B溶液中溶质的质量 C溶液的质量 D甲的质量分数 Et2℃时甲的溶解度
保持温度不变,将饱和溶液稀释,不变的量是______________(填序号,下同)
如果该饱和溶液降温至t1℃,不变的量是____________。
【答案】t1℃时,甲的溶解度和乙的溶解度相同 饱和 44.4% 降温结晶(冷却热的饱和溶液/冷却结晶) 温度升高,溶解度减小 BE AE
【解析】
由甲、乙两种物质的溶解度曲线可知,甲的溶解度随温度的升高而增大,乙的溶解度随温度的升高而减小。
① M点是甲、乙两种物质的溶解度曲线的交点,表示的意义是t1℃时,甲的溶解度和乙的溶解度相同。
② t2℃时,甲物质的溶解度为80g,将40g的甲物质放入盛有50g水的烧杯中,溶解的甲物质的质量为![]() ,故所得溶液为饱和溶液,此时溶质的质量分数为
,故所得溶液为饱和溶液,此时溶质的质量分数为
![]() 。
。
③甲的溶解度随温度的升高而增大,乙的溶解度随温度的升高而减小,故从甲溶液中提纯甲的方法是降温结晶(冷却热的饱和溶液/冷却结晶)。
④乙的溶解度随温度的升高而减小,加热乙的饱和溶液出现浑浊,原因是温度升高,溶解度减小。
⑤保持温度不变,将饱和溶液稀释,不变的量是溶液中溶质的质量,t2℃时甲的溶解度,故选BE。
如果该饱和溶液降温至t1℃,不变的量是水的质量,t2℃时甲的溶解度,故选AE。


 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:初中化学 来源: 题型:
【题目】实验中小明手遇高锰酸钾后皮肤变色了,于是对高锰酸钾的腐蚀性展开研究。
(实验1)20C时将相同大小的新鲜鸡皮在不同浓度的高锰酸钾溶液中浸泡相同时间,现象如下表。
溶液中高锰酸钾的质量分数 | 0.002% | 0.01% | 0.1% | 1% |
鸡肉皮的变化 | 无明显变化 | 边缘部分变为棕黄色 | 全部变为棕色 | 全部变为黑色 |
(实验2)20℃时将相同大小的铜片分别在4种液体中浸泡相同时间后,测铜片质量变化,数据如下表。
试验编号 | ① | ② | ③ | ④ | |
实验用的溶液 | 25 mL 0.1%高锰酸钾溶液 | 25mL 0.1%高锰酸钾溶液 | 25 mL蒸馏水+10滴浓硫酸 | 25mL1%高锰酸钾溶液+10滴浓硫酸 | |
铜片质量/g | 实验前 | 0.54 | 0.54 | 0.54 | 0.54 |
18小时后 | 0.54 | 0.52 | 0.54 | 0.42 | |
回答下列问题:
(1)实验1的目的是_______________。若要证明温度对0.05%的高锰酸钾溶液腐蚀鸡皮的影响,你设计的实验是__________________.
(2)实验2中通过对比②和④,得出的结论是___________
(3)实验2中,欲得出“高锰酸钾和硫酸共同作用对铜才有腐蚀性”的结论,需要对比的实验是_______________(填实验编号)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某小组同学在实验室进行实验,请你参与。
(1)同学们先取少量在空气中久置的氢氧化钠固体样品加水配制成溶液,另取2mL该溶液于小烧杯中,然后滴加几滴酚酞溶液,振荡,此时观察到的实验现象为:_____________________。接着向烧杯中逐滴加入稀盐酸并用玻璃棒搅拌,溶液的颜色改变,同时观察到有气泡产生。结论:氢氧化钠变质。请化学方程式解释氢氧化钠变质的原因:_____________________。
(2)针对氢氧化钠变质的程度做了进一步探究。
(作出猜想)猜想一:样品部分变质,成分为NaOH、Na2CO3;
猜想二:样品完全变质,成分为_______________。
(查阅资料)①BaCl2溶液显中性,BaCO3难溶于水。②向碳酸钠溶液中逐滴加入稀盐酸的反应是分步反应,会发生生成碳酸氢钠和氯化钠的反应。
(实验探究)为验证猜想,同学们设计了两个方案,并进行实验。
①定性方案设计,请你将该实验设计补充完整。
实验内容 | 实验现象 | 得出结论 |
取少量样品溶液,加入足量BaCl2溶液,静置,向上层清液中滴加几滴无色酚酞溶液 | ______________ | 猜想一正确 |
②定量方案设计 先准确称取 11.95g 变质的NaOH样品放入锥形瓶中,用电子秤称得锥形瓶及样品的总质量为46.95g,再把 150.00 g7.3 %稀盐酸平均分成 6等份,每份25.00g依次在充分摇动锥形瓶时,加入样品中,每次充分反应后用电子秤称得锥形瓶及所盛物质的质量,实验数据记录如下:
加入盐酸的次数 | 第一次 | 第二次 | 第三次 | 第四次 | 第五次 | 第六次 |
锥形瓶及所盛物质总质量/g | 71.95 | 96.95 | 120.85 | 144.75 | 168.65 | 193.65 |
(实验结论)请根据上述实验数据,计算样品中氢氧化钠的质量分数为______(精确到0.1%),猜想一正确。
(反思交流)
①在如图的直角坐标系中画出产生气体的质量与所加稀盐酸质量的关系曲线______。

②请判断第二次加入盐酸过程中发生反应的化学方程式_________________,原因______________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】氯化钠俗称食盐,是维护人体生命的重要物质。
①从海水中提取氯化钠,并以氯化钠和水为原料在通电条件下制取氢氧化钠、氢气和氯气(Cl2)。
(I)从海水中获取粗盐,宜选用__________(填“蒸发结晶”或“降温结晶”)。
(II)氯化钠饱和溶液通电后反应的化学方程式是__________。
(III)粗盐初步提纯时过滤操作中需要将圆形滤纸折叠处理,下图中不该出现的情形是__________(填编号)。

②实验室一瓶氯化钠中混有硫酸钠。提纯流程如下:

(I)加入BaCl2溶液时发生反应的化学方程式是__________。
(II)加入过量 Na2CO3溶液的目的是___________。
(III)此设计方案是否严密,说明理由______________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】黄铜矿经初步处理后,所得溶液甲中的溶质为Fe2(SO4)3、CuSO4及H2SO4,利用以下实验可制取补血剂原料碳酸亚铁并回收铜。

步骤I中,发生反应的化学方程式包括:
①Fe2(SO4)3+Fe→3FeSO4,
②_____,
③_____。
步骤II中加入一种试剂(Na2CO3)可实现其转化,将试剂(Na2CO3)进行焰色反应,观察得到的火焰颜色是__________色。
步骤III回收铜的主要实验操作包括:①过滤,②加足量稀硫酸,③洗涤、干燥,正确的操作顺序是_____(填序号)。
若废铁屑含有少量铁锈,对回收铜_____(填“有”或“无”)影响。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】70 ℃时,将100 g溶质的质量分数为20%的R溶液不断降温,析出固体R的质量与温度的变化关系如下图所示。根据图像回答下列问题:

(1) R的溶解度随温度的升高而______________(填“增大”、“不变”或“减小”);
(2)从70 ℃降到50 ℃的过程中,该溶液中溶质的质量分数_________(填“变大”、“变小”或“不变”);
(3)要配制50℃时50 g R的饱和溶液,需要R的质量是 ________ g , 需要的玻璃仪器有_________ 。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】氯化钠与硝酸钾的部分溶解度如下(单位:g/100g水)。
温度(℃) | 20 | 40 | 60 | 80 | 100 |
氯化钠 | 36.0 | 36.6 | 37.3 | 38.4 | 39.8 |
硝酸钾 | 31.6 | 63.9 | 110 | 169 | 246 |
①请你根据表格中的数据,将氯化钠的溶解度曲线补充完成。(在虚线框内作图)____。
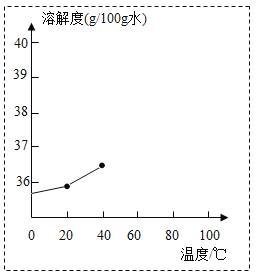
②在20℃时,将50克硝酸钾溶解在100克水中,形成的是____(填“饱和”或“不饱和”)溶液,若升温至40℃,则烧杯中溶液的溶质质量分数为____(精确到0.1%)
③某温度时,氯化钠与硝酸钾的溶解度相等均为S g/100g水,则S的最小范围是______。
④在固体硝酸钾中混有少量氯化钠可以通过溶解,蒸发浓缩,降温结晶,过滤等步骤分离提纯硝酸钾。可以利用该方法分离的理由是_____。
A 固体混合物中硝酸钾的含量较高,氯化钠的含量较低。
B 硝酸钾的溶解度受温度影响变化较大。
C 40℃至100℃,硝酸钾的溶解度始终大于氯化钠。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某气体可能含有一氧化碳、二氧化碳、水蒸气中的一种或几种。某小组利用如图装置探究气体的成分。请用装置序号填空(装置不重复使用)。

(1)若检验气体中存在水蒸气,可将气体通过装置_____;该装置中反应的化学方程式为_____。
(2)将气体依次通过装置_____,可一次性确定该气体的成分。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com