
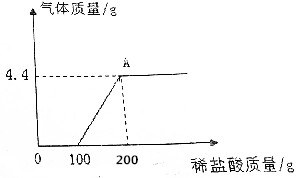
 称取部分变质的NaOH样品18.6g(只含两种物质)溶于85.8g水中,向溶液中逐渐加入稀盐酸得到如图关系.
称取部分变质的NaOH样品18.6g(只含两种物质)溶于85.8g水中,向溶液中逐渐加入稀盐酸得到如图关系.分析 (1)根据题意可以知道生成了二氧化碳,可以根据化学方程式求算出碳酸钠的质量进而求算出氢氧化钠的质量;
(2)根据化学方程式计算出氯化氢的质量,然后结合质量分数的计算公式计算出盐酸的质量分数;
(3)根据碳酸钠的质量可以求得样品中氢氧化钠的质量,再根据氢氧化钠的质量可以求得反应产生的氯化钠的质量;则完全反应后溶质的质量为碳酸钠与盐酸反应生成的氯化钠的质量加氢氧化钠与盐酸反应生成氯化钠的质量;根据质量守恒定律可以求得反应后溶液的总质量,最后结合溶液中溶质的质量分数的计算公式进行计算即可.
解答 解:(1)由图表可知反应开始消耗100g盐酸是和氢氧化钠反应,继续消耗100g盐酸是和碳酸钠反应,且生成了二氧化碳气体4.4g;
设样品中碳酸钠质量为x,与碳酸钠反应消耗氯化氢的质量为y,生成氯化钠的质量为z,则:
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 73 117 44
x y z 4.4g
$\frac{106}{x}=\frac{73}{y}=\frac{44}{4.4g}$
解得:x=10.6g,y=7.3g
$\frac{117}{z}=\frac{44}{4.4g}$
z=11.7g
所以氢氧化钠的质量为:18.6g-10.6g=8g
(2)根据题意可以知道,生成4.4g二氧化碳消耗盐酸的质量为:200g-100g=100g
所以稀盐酸的质量分数为:$\frac{7.3g}{100g}×$×100%=7.3%
(3)样品中氢氧化钠的质量为18.6g-10.6g=8g;
设氢氧化钠与盐酸反应生成的氯化钠的质量为w;
NaOH+HCl═NaCl+H2O
40 58.5
8g w
$\frac{40}{8g}=\frac{58.5}{w}$
w=11.7g
A点时溶液溶质的质量分数是:$\frac{11.7g+11.7g}{18.6g+200g-4.4g}×$100%≈10.9%
答案:
(1)10.6g;
(2)所用盐酸中溶质质量分数为7.3%;
(3)在点A所得不饱和溶液中,溶质质量分数为10.9%.
点评 本题难度较大,主要考查了通过图象分析有价值的数据,然后根据化学方程式进行有关量的计算,培养学生的分析能力和解决问题的能力.


 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:选择题
| A. | 大于45% | B. | 等于45% | C. | 小于45% | D. | 无法确定 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验内容 | 观察到的现象 |
| A+B | 有气泡产生 |
| A+C | 有白色沉淀生成 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
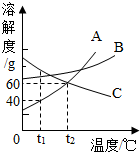 如图是A、B、C三种物质的溶解度曲线.下列说法不正确的是( )
如图是A、B、C三种物质的溶解度曲线.下列说法不正确的是( )| A. | t1℃时,100g水溶解了40gA就达到了饱和状态 | |
| B. | t2℃时,A和C的饱和溶液中溶质的质量分数相等 | |
| C. | t2℃时C的饱和溶液降温到t1℃时有晶体析出 | |
| D. | A和B的饱和溶液从t2℃降温到t1℃时,溶液的溶质质量分数都变小 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
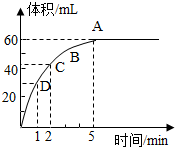 为了研究MnO2与双氧水(H2O2)的反应速率,某学生加入少许的MnO2 粉末于50mL密度为1.1g?cm-3 的双氧水溶液中,通过实验测定:在标准状况下放出气体的体积和时间的关系如右图所示.请依图回答下列问题:
为了研究MnO2与双氧水(H2O2)的反应速率,某学生加入少许的MnO2 粉末于50mL密度为1.1g?cm-3 的双氧水溶液中,通过实验测定:在标准状况下放出气体的体积和时间的关系如右图所示.请依图回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 操作 |  | 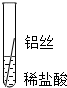 | 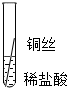 | 根据现象得出金属活动性顺序 |
| 片刻后现象 | 有少量气泡 | 无气泡 | 无气泡 | Fe>Al,Fe>Cu |
| 几分钟后现象 | 有少量气泡 | 有大量气泡 | 无气泡 | Al>Fe>Cu |
| 操作 | 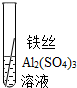 | 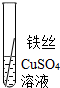 | 根据现象得出金属活动性顺序 |
| 现象 | 无明显现象 | 铁丝表面有红色物质析出 | Al>Fe>Cu |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 空气中含有大量的稀有气体,它们可以制成多种用途的电光源 | |
| B. | 空气中分离出的氮气化学性质不活泼,食品包装中充氮气可以防腐 | |
| C. | 加快地铁建设,减少机动车尾气排放,有利于提高空气质量 | |
| D. | 控制PM2.5的排放,减少雾霾天气 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 苯甲酸钠由4种元素组成 | |
| B. | 食品添加剂影响人体健康,所以使用时要严格控制使用量 | |
| C. | 苯甲酸钠的相对分子质量为144 | |
| D. | 每个苯甲酸钠分子中含有一个氧分子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com