
| A.观察固体的颜色和外观 | B.放入水中试其溶解性 |
| C.用嘴尝其味道 | D.加热观察是否有变化 |
科目:初中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:初中化学 来源:不详 题型:单选题
| A.假设和猜想 | B.设计实验 | C.操作实验 | D.做出结论 |
查看答案和解析>>
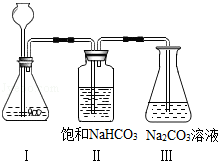
科目:初中化学 来源:不详 题型:实验题
| 实验步骤 | 实验现象 |
| Ⅰ.分别量取5mL5%过氧化氢溶液放入A、B 两支试管中,向A试管中加入ag氧化铁粉末,并分别在A、B两支试管中插入带火星木条,观察现象。 | A试管中产生气泡,带火星木条复燃,B试管中无明显现象 |
| Ⅱ.待A试管中没有现象发生时,重新加入过氧化氢溶液,并把带火星的木条伸入试管,如此反复多次试验,观察现象。 | 试管中均产生气泡,带火星木条均复燃 |
| Ⅲ.将实验Ⅱ中的剩余物小心过滤,并将所得滤渣进行洗涤、干燥、称量,所得固体质量仍为ag。 | |
| Ⅳ.分别量取5mL5%过氧化氢溶液放入C、D 两支试管中,向C试管中加入ag氧化铁粉末,向D试管中加入ag二氧化锰粉末,观察现象。 | |
查看答案和解析>>
科目:初中化学 来源:不详 题型:单选题
| A.猜想假设 | B.设计实验 | C.收集证据 | D.得出结论 |
查看答案和解析>>
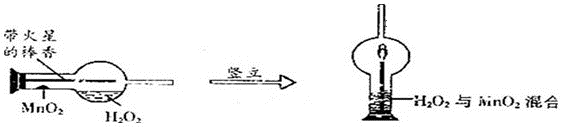
科目:初中化学 来源:不详 题型:实验题
查看答案和解析>>
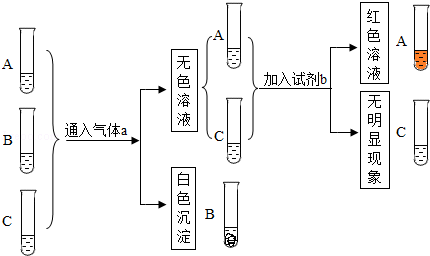
科目:初中化学 来源:不详 题型:实验题
查看答案和解析>>
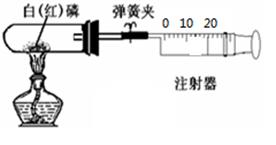
科目:初中化学 来源:不详 题型:实验题
| 猜想1 | 猜想2 | 猜想3 |
| 只有CO | 只有 | CO、CO2都有 |

查看答案和解析>>
科目:初中化学 来源:不详 题型:实验题
| 实验过程 | 实验现象 | 实验结论 |
 | ①号试管:固体溶解,产生气泡,放热; ②号试管: . | a、金属活动性: 镁 铜(填“>”或“<”) b、涉及到的化学方程式 . |
(2) | ③号试管:绿色粉末逐渐溶解,产生气泡,溶液显蓝色. ④号试管:绿色粉末逐渐溶解,产生气泡,溶液显绿色. | Cu2(OH)2CO3+2H2SO4═2CuSO4+3H2O+CO2↑ Cu2(OH)2CO3+4HCl═2CuCl2+3H2O+CO2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com