
科目:初中化学 来源: 题型:阅读理解
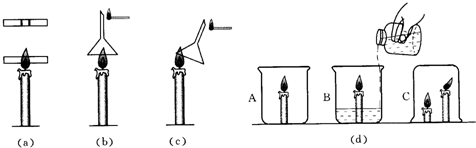

查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| ||
| ||
| 步骤 | 实验操作 | 主要实验现象 | 结论(燃烧产物判断) |
| (1) | 将产物溶于适量水中 | 部分溶解,试管底部有黑色固体 | 燃烧产物中肯定有 C(碳) C(碳) |
| (2) | 取(1)所得少量上层清液,加入过量的BaCl2溶液 | 有白色沉淀生成 有白色沉淀生成 |
燃烧产物中肯定有Na2CO3 |
| (3) | 取(2)所得少量上层清液,加入 酚酞 酚酞 溶液 |
溶液变成红色 | 燃烧产物中肯定有 Na2O Na2O |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| ||
| ||
| ||
| ||
| ||
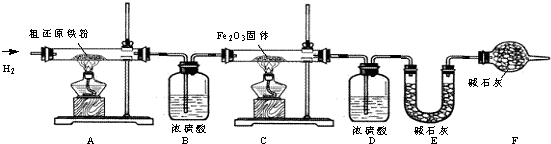
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解

| 组别 | 一 | 二 | 三 | ||||||||
| 集气瓶编号 | ① | ② | ③ | ④ | ⑤ | ① | ② | ③ | ④ | ⑤ | ① |
| 瓶中O2占容积的体积分数(%) | l0 | 20 | 30 | 40 | 50 | 3l | 33 | 35 | 37 | 39 | 34 |
| 带火星木条的状况 | 微亮 | 亮 | 很亮 | 复燃 | 复燃 | 很亮 | 很亮 | 复燃 | 复燃 | 复燃 | 很亮 |
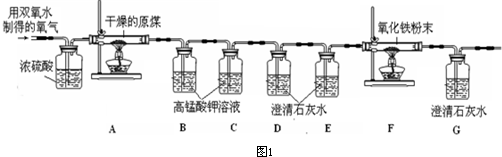

查看答案和解析>>
科目:初中化学 来源:2013-2014学年江苏省无锡市新区九年级上学期期中考试化学试卷(解析版) 题型:探究题
已知废旧普通干电池筒内主要有C、淀粉、MnO2、ZnCl2、NH4C1等物质,某化学兴趣小组同学欲通过实验从中回收MnO2,并研究MnO2在分解过氧化氢制氧气的反应中所起的作用。
【查阅资料】淀粉不溶于冷水,完全燃烧生成二氧化碳和水;碳、二氧化锰不溶于水。
ZnCl2、NH4Cl均易溶于水。
【进行实验】实验步骤如下图:

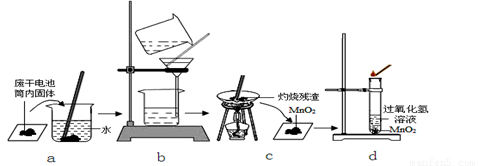
步骤b所对应的操作名称是 ,其中玻璃棒所起的作用是 ;
步骤c灼烧残渣的目的是除去 ;步骤d中,加入MnO2后带火星的木条复燃。
【得出结论】因此MnO2在分解过氧化氢制氧气的反应中起催化作用。
【交流与反思】该化学兴趣小组同学对上述结论进行了讨论,认为要想确定MnO2在分解过氧化氢制氧气的反应中起催化作用,还需通过实验证明MnO2的 和 在反应前后都没有发生变化。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com