
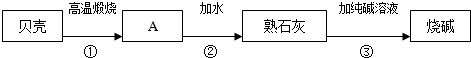
分析 (1)贝壳的主要成分为CaCO3,碳酸钙高温分解生成氧化钙和二氧化碳,氧化钙与水反应生成氢氧化钙,进行分析解答.
(2)步骤③,即氢氧化钙与碳酸钠溶液反应生成碳酸钙沉淀和氢氧化钠,写出反应的化学方程式即可.
解答 解:(1)贝壳的主要成分为CaCO3,碳酸钙高温分解生成氧化钙和二氧化碳,氧化钙与水反应生成氢氧化钙,则A为氧化钙,其化学式是CaO.
(2)步骤③,即氢氧化钙与碳酸钠溶液反应生成碳酸钙沉淀和氢氧化钠,反应的化学方程式为:Ca(OH)2+Na2CO3═CaCO3↓+2NaOH.
故答案为:(1)CaO;(2)Ca(OH)2+Na2CO3═CaCO3↓+2NaOH.
点评 本题难度不大,熟练掌握碳酸钙、氧化钙、氢氧化钙之间的转化、盐的化学性质、化学方程式的书写方法是正确解答本题的关键.


 高中必刷题系列答案
高中必刷题系列答案科目:初中化学 来源: 题型:填空题
| 宏观现象 | 微观本质 | 符号或图示表达 |
| (1)温度升高压强不变,气体体积增大; | 温度升高,分子间的间隔变大 |  |
| (2)水通电分解,观察到电极表面都有气泡产生; | 水分子变成氢分子和氧分子 | 化学方程式为2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑. |
| (3)向氢氧化钠溶液中滴加3滴酚酞溶液,再向该溶液中逐滴加入稀盐酸;观察到溶液由红色变为无色. | 该反应的实质是氢离子和氢氧根离子结合成水分子 | 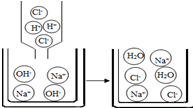 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 日常生活中接触的金属材料,大多属于合金.其中黄铜是以锌作主要添加元素的铜合金.已知组成某弹壳的黄铜中只含有锌和铜,现将22g该弹壳碾成粉末后放入盛有足量的稀硫酸烧杯中,测得反应过程中生成的氢气的质量(单位为g)与反应时间(单位为min)的关系如图所示.试计算:
日常生活中接触的金属材料,大多属于合金.其中黄铜是以锌作主要添加元素的铜合金.已知组成某弹壳的黄铜中只含有锌和铜,现将22g该弹壳碾成粉末后放入盛有足量的稀硫酸烧杯中,测得反应过程中生成的氢气的质量(单位为g)与反应时间(单位为min)的关系如图所示.试计算:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 太阳能电动车是在电动车的基础上,将太阳能转化成电能对车进行供电的,在很大程度上降低了电动车的使用成本,及时有效地补充电动车野外行驶途中的电量.请回答下列相关问题:
太阳能电动车是在电动车的基础上,将太阳能转化成电能对车进行供电的,在很大程度上降低了电动车的使用成本,及时有效地补充电动车野外行驶途中的电量.请回答下列相关问题:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 向12.2克碳酸钠和硫酸钠的混合物加入一定质量的稀硫酸后恰好完全反应,测得反应前后烧杯和所盛物质的总质量(m)与反应时间(t)的关系如图.其中烧杯的质量为30克(已知Na2CO3+H2SO4═Na2SO4+H2O+CO2↑).试计算:
向12.2克碳酸钠和硫酸钠的混合物加入一定质量的稀硫酸后恰好完全反应,测得反应前后烧杯和所盛物质的总质量(m)与反应时间(t)的关系如图.其中烧杯的质量为30克(已知Na2CO3+H2SO4═Na2SO4+H2O+CO2↑).试计算:查看答案和解析>>
科目:初中化学 来源: 题型:推断题
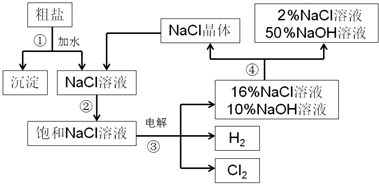
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com