
人类的生产生活离不开金属。
(1)在地壳里含量最多的金属元素是 。
(2)我国是世界上最早使用湿法炼铜的国家,其反应原理是 。(用
化学方程式表示)。下列铜制品的用途中,利用金属导电性的是 (填字母)。
| A.铜火锅 | B.铜导线 | C.铜钟 | D.铜钱 |
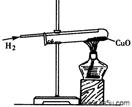
(1)Al (2)Fe + CuSO4 =" Cu" + FeSO4 (3) 氧气(空气) 二氧化碳
(4)没哟继续通入氢气至试管冷却。
解析试题分析:(1)地壳中含量的元素由多到小的是:氧、硅、铝、铁,氧和硅是非金属元素,铝和铁是金属元素,故在地壳里含量最多的金属元素是:Al ;(2)我国是世界上最早使用湿法炼铜的国家,其反应原理是Fe + CuSO4 =" Cu" + FeSO4 ;铜导线是利用铜的导电性,故选B;(3)根据铁生锈的条件可知铁在同时有水和氧气或空气的条件下易生锈,根据质量守恒定律可知,铜锈是由Cu元素、H元素、O元素、C元素组成,故铜锈的化学式为Cu2(OH)2CO3,其生锈的条件与铁有相似之处,另外,还可能与空气中的二氧化碳有关。(4)因为铜在高温下能与空气中的氧气反应生成氧化铜,所以防止铜和氧气反应,要继续通入氢气至试管冷却。
考点:地壳元素的含量,质量守恒定律,化学方程式的书写。


 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:初中化学 来源: 题型:填空题
现有银、铜、铁三种金属,某研究小组为探究银、铜、铁的金属活动性顺序,设计了三
个实验:(Ⅰ)将铁片浸入稀硫酸中;(Ⅱ)将银片浸入稀硫酸中;(Ⅲ)将铁片浸入硫酸铜溶液中。
实验(Ⅲ)中反应的化学方程式为 ;该反应的基本类型为 反应
上述三个实验还不能完全证明三种金属的活动性顺序,请你补充一个实验来达到实验目的(写出实验操作和现象) 。根据以上探究,三种金属的活动性由强到弱的顺序是 。
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
事物都具有两面性。如:CO可作冶金工业原料,却对人体健康有害;O2可用于急救病人,维持生命活动需要,却参与钢铁的锈蚀过程。
(1)写出高炉炼铁中CO还原氧化铁的化学反应方程式: ;
(2)金属材料包括纯金属以及它们的合金,黄铜(含铜和锌)、生铁都属于 。钢和生铁由于 元素含量的不同,使得钢和生铁的坚韧性有较大差异。
(3)将黄铜和生铁分别放人足量的稀盐酸中,浸泡后都有残留固体,其中一种固体一定含 ,另一种固体一定含 。
(4)铁浸泡在盐酸中发生反应的化学方程式为 , 该反应的基本类型是 。
(5)食品包装中,有一些是用铁粉做双吸剂,铁粉既可以防腐又可以保持食品干燥,是因为铁粉能吸收空气中的 和 。
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
人类的生产和生活都离不开金属.
(1)金属元素在自然界中分布很广,地壳中含量最多的金属元素是 .金属以矿物形式存在,下列矿石的主要成分属于氧化物的是 (填化学式).
赤铁矿 孔雀石 铝土矿
(主要成分Fe2O3)〔主要成分Cu2(OH)2CO3〕(主要成分Al2O3)
(2)金属的回收和利用是保护金属资源的一种有效途径.
①废钢铁可回收重新冶炼,用一氧化碳还原氧化铁的化学方程式为 .
②向含有AgNO3、Cu(NO3)2、Zn(NO3)2的混合溶液中加入一定量的铁粉,使其充分反应后,过滤,向滤渣中滴加稀盐酸,有气泡产生,则下列结论正确的是
| A.固体中一定有Fe、Ag,可能有 Cu、Zn |
| B.固体中一定有Fe、Zn,可能有 Cu、Ag |
| C.滤液中一定含Fe2+、Zn2+,不含Cu2+、Ag+ |
| D.滤液中一定含Zn2+、Fe2+,可能含Cu2+ |

查看答案和解析>>
科目:初中化学 来源: 题型:填空题
同学们即将初中毕业.在离开母校之际,整理自己的物品时,若清理出如下物品:①废作业纸 ②易拉罐 ③变质饼干 ④生锈铁钉。
(1)应该放入“不可回收垃圾箱”的是 (用序号填写)。
(2)生锈铁钉可用酸除锈,把一根生锈放入过量稀盐酸中,过一会儿,可看到现象是 ,此时溶液中的阳离子有 ;过一段时间,还会看到铁钉表面有 产生,产生该现象的化学方程式为 。
(3)X、Y、Z是金属活动性顺序表中的三种固态金属,如果把X、Y、Z分别放入稀硫酸中,X溶解并产生氢气,Y、Z不反应;把Y和Z分别放入硝酸银溶液中,过一会儿,在Z表面有银析出,而Y没有变化。根据以上实验事实,回答下列问题:
①X、Y和Z的金属活动性由强到弱的顺序为 ;
②写出在Z表面有银析出的反应化学方程式 。
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
铝、铁、铜是人类广泛使用的三种金属,与我们生活息息相关.
(1)在空气中 制品(填“铝”或“铁”)更耐腐蚀.
(2)人们大量使用的是合金而不是纯金属,这是因为合金具有更多优良性能,例如钢比纯铁硬度 (填“大”或“小”).
(3)用下列试剂验证这三种金属的活动性顺序,能达到目的是 (填序号).
A.硫酸铝溶液 B.硫酸亚铁溶液 C.硫酸铜溶液
(4)硫酸和盐酸都能除铁锈,写出盐酸与铁锈主要成分反应的化学方程式 .
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
钢铁是使用最多的金属材料.
(1)铁制品在一定条件下能生锈,疏松的铁锈不能阻碍里层的铁继续与 反应,因此铁制品可以进一步锈蚀.防止自行车链条生锈的合理措施是 .用盐酸除铁锈的化学方程式为 .
(2)用一氧化碳和赤铁矿炼铁的化学方程式为 .回收利用废旧金属制品的目的之一是 .
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
012年6月,“蛟龙”号载人潜水器创造了我国载人深潜新纪录,实现了我国深海技术发展的重大跨越。
(1)蛟龙”号身披能抗超高压的钛合金“龙甲”。钛合金属于 材料,它的硬度(填“小于”或“大于”)金属钛的硬度;
(2)下潜时,载人舱里的气体与外界空气相同,其中氧气的体积分数约为 %;
(3)深海潜航中可观察海底的“热液”与“冷泉”现象。前者是海水渗入地下,被熔岩加热后重返海底的活动。该海水中的丰富矿物地重返地表时遭遇冷水后沉积,沉积的主要原因是: 。后者的形成原因之一是海底天然气的溢出,天然气的主要成分是甲烷,完全燃烧生成二氧化碳和水,写出该反应的化学方程式: 。
查看答案和解析>>
科目:初中化学 来源: 题型:探究题
钢铁产业是我国的支柱产业之一,选择优质炼铁原料十分重要。甲、乙两组同学对某钢铁厂所购进的赤铁矿粉中主要成分Fe2O3的含量进行测定。(假设每步反应均能完全进行,赤铁矿粉中的杂质性质稳定,既不溶于水也不参与反应)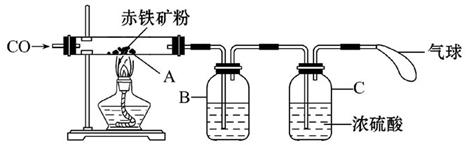
(1)甲组同学称取一定质量的赤铁矿粉,采用如图装置进行实验。
①装置A中发生反应的化学方程式是 。
②为充分吸收反应生成的CO2,装置B中应盛放的试剂是浓 溶液。
③可以通过下面不同的方法计算赤铁矿粉中Fe2O3的含量。
方法一:称量反应前后装置A的总质量,计算出Fe2O3的含量。
方法二:称量 ,得出反应生成的CO2的质量,计算出Fe2O3的含量。
(2)乙组同学称取等质量的赤铁矿粉放入烧杯中,向烧杯中加入过量的稀硫酸充分反应, (填一个操作名称)后立即称量。根据称量的数据计算出Fe2O3的含量。
(3)甲、乙两组同学通过相互比较后对各自的实验方案进行评价。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com