金属材料和化石燃料是人类重要的资源,合理利用和保护人类资源在生产生活中至关重要.
(1)铝是活泼金属,但铝的耐腐蚀性却较强,其原因用化学方程式表示为:________.
(2)废液中含硝酸亚铁和硝酸银,为回收贵重金属银,并得到硝酸亚铁溶液,可在废液中加入某物质,再过滤,化学反应方程式为________.
(3)在汽车排气管上安装一个“催化转化器”,其作用是使CO和NO反应生成N2和CO2.该反应的化学方程式为________.
(4)为了减少使用汽油带来的尾气污染,目前正在提倡使用乙醇汽油,在汽油中加入乙醇,乙醇燃烧的反应方程式为________.
解:(1)铝有较强的抗腐蚀性原因是铝在常温下与氧气反应生成氧化铝,氧化铝是一层致密的氧化膜,对里面的金属起着保护作用,该反应的化学方程式是4Al+3O
2═2Al
2O
3;
故答案为:4Al+3O
2═2Al
2O
3;
(2)废液中含硝酸亚铁和硝酸银,为回收贵重金属银,并得到硝酸亚铁溶液,可在废液中加入足量的铁粉,铁置换出硝酸银中的银,同时生成硝酸亚铁,再过滤,即可得到金属银,该反应方程式为Fe+2AgNO
3═Fe(NO
3)
2+2Ag;
故答案为:Fe+2AgNO
3═Fe(NO
3)
2+2Ag;
(3)根据题干信息:在汽车的排气管上装一个“催化转化器”,其作用是使CO和NO反应,生成N
2和CO
2.可知化学反应式是:2CO+2NO
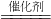
2CO
2+N
2;
故答案为:2CO+2NO
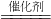
2CO
2+N
2;
(4)乙醇燃烧时生成二氧化碳和水,反应的化学方程式是:C
2H
5OH+3O
2 
2CO
2+3H
2O.
故答案为:C
2H
5OH+3O
2 
2CO
2+3H
2O.
分析:(1)根据铝在常温下与氧气反应生成氧化铝起着保护作用分析;
(2)根据除杂的原则结合金属的性质分析;
(3)根据反应物、反应条件和生成物写出化学反应式;
(4)根据反应物、反应条件和生成物写出化学反应式.
点评:本题考查金属铝的化学性质以及化学反应式的书写,同学们要具备根据反应物、反应条件和生成物写出化学反应式的能力.

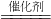 2CO2+N2;
2CO2+N2;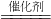 2CO2+N2;
2CO2+N2; 2CO2+3H2O.
2CO2+3H2O. 2CO2+3H2O.
2CO2+3H2O.
