
【题目】某矿石主要成分是 MgO,含少量的 Fe2O3、CuO 和 SiO2杂质。用该矿石制备Mg(OH)2的工艺流程简图如图:
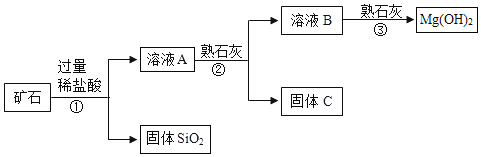
已知氢氧化铜、氢氧化铁和氢氧化镁均是沉淀,请回答下列问题:
(1)步骤①和步骤②均用到的操作是__________,需要的玻璃仪器有烧杯、漏斗和_____________。
(2)溶液 A 中所含的阳离子有 Fe3+、Cu2+、Mg2+和 __________(填离子符号)。
(3)已知部分金属阳离子以氢氧化物形成沉淀时溶液的 pH 见下表:
对应离子 | Fe3+ | Cu2+ | Mg2+ |
开始沉淀时的 pH | 1.9 | 4.2 | 9.1 |
完全沉淀时的 pH | 3.2 | 6.7 | 11.1 |
步骤②加入熟石灰,调节溶液的 pH 范围为_______________;固体 C 中所含固体成分的化学式为______________;该步骤②中所涉及的中和反应的化学方程式是______________。
(4)步骤③制取 Mg(OH)2的化学方程式为______________。
【答案】过滤 玻璃棒 H + 6.7≤pH<9.1 Cu(OH)2和 Fe(OH)3 ![]()
![]()
【解析】
(1)步骤①和步骤②都能将固体与液体分离,均用到的操作是过滤,需要的玻璃仪器有烧杯、漏斗和玻璃棒;
(2)盐酸和氧化铁反应生成氯化铁和水,和氧化铜反应生成氯化铜和水,和氧化镁反应生成氯化镁和水以及盐酸是过量的,所以溶液A中所含的阳离子有Fe3+、Cu2+、Mg2+和H +;
(3)由铁离子、铜离子沉淀时的pH值和镁离子开始沉淀的pH值可知,需将Fe3+、Cu2+沉淀,Mg2+不产生沉淀,所以步骤②加入熟石灰,调节溶液的pH范围为:6.7≤pH<9.1,固体C中所含成分的化学式为Cu(OH)2和 Fe(OH)3;该步骤②中所涉及的中和反应是氢氧化钙和盐酸反应生成氯化钙和水,反应的化学方程式是![]() ;
;
(4)氯化镁和氢氧化钙反应生成氢氧化镁沉淀和氯化钙,化学方程式为:![]() 。
。


科目:初中化学 来源: 题型:
【题目】人类历史发展的不同阶段曾以不同金属材料的使用作为标志。

(1)金、银在自然界有单质形式存在,说明它们的化学性质都___________。
(2)在生产生活实践中人类逐渐掌握多种金属的技术。
①比较两种铁矿石磁铁矿(主要成分Fe3O4) 和菱铁矿(主要成分FeCO3), 从化学的角度分析“磁铁矿作炼铁原料更具优势”,其原因是___________。
②近代工业上采用电解熔融氧化铝(Al2O3)的方法冶炼铝,Al2O3分解后得到两种单质,该反应的化学方程式为____________。
(3)钛和钛合金是21世纪的重要的金属材料,钛合金制品放在海水中数年取出后仍光亮如新,是因为其____ (填序号) 非常好。
A 可塑性.
B 机械性能
C 抗腐蚀性能
(4)铁在潮湿的空气中反应生成疏松的铁锈,铁锈的主要成分是__________(填化学式)。
(5)利用“活泼金属”可以制得H2,H2可用作汽车能源,若推广应用于汽车产业,则需要综合考虑的因素有________(填序号)。
a 金属原料的成本
b 生产过程中的能源消耗和污染
c 金属的回收利用
查看答案和解析>>
科目:初中化学 来源: 题型:
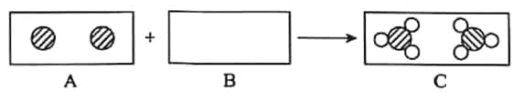
【题目】如图为两种气体发生反应的微观过程,其中不同小球代表不同原子。下列说法正确的是
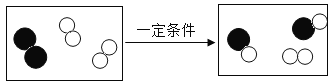
A.化学反应前后分子的种类不变
B.该反应前后各元素化合价均无变化
C.该反应的基本反应类型是化合反应
D.参加反应的![]() 和
和![]() 分子个数比为1:2
分子个数比为1:2
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】一定质量的某有机化合物完全燃烧,生成2.2gCO2和1.8gH2O,另取3.2g该有机化合物在O2中完全燃烧,消耗4.8gO2,该有机化合物的化学式可能是
A. C2H4 B. CH4O C. CH4 D. C2H4O
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】甲、乙两种固体(不含结晶水)的溶解度曲线如图所示。下列说法正确的是 ( )
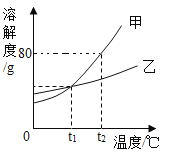
A.t1℃时,甲、乙溶液溶质的质量分数相等
B.甲中含有少量乙时,可用降温结晶法提纯甲
C.t2℃时,将 50g 甲加入 50g 水中,可以得到 100g 溶液
D.t2℃时的甲、乙饱和溶液分别降温到 t1℃时,析出晶体的质量甲大于乙
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图所示,在盛有冷水的烧杯中放入甲、乙两支试管(试管中都有未溶解的该溶液的溶质),若使甲试管中晶体减少,乙试管中晶体增多,需向烧杯中加入的物质是
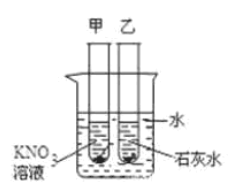
A.氯化钠B.氢氧化钠C.硝酸铵D.硝酸钾
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】铟与氯气反应生成氯化铟的微观过程可表示为
(1)请将B框中的信息补画完整____(要求:在纸上先把B框画出,再把B框补画完整),并且说出你这样补充的理由是什么?____________
(2)该反应的基本反应类型为__________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】小明在做铁与硫酸溶液反应的实验时,发现生成的气体有刺激性气味,于是进行了探究.
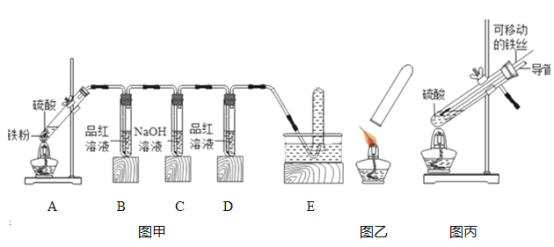
【提出问题】铁与硫酸溶液反应生成的气体为什么有刺激性气味?
【查阅资料】
(1)6H2SO4(浓)+2Fe![]() Fe2(SO4)3+6H2O+3SO2↑
Fe2(SO4)3+6H2O+3SO2↑
(2)SO2可使品红溶液的红色褪去
【进行猜想】铁与不同浓度的硫酸溶液反应,生成的气体产生可能有二氧化硫
【实验探究】小明用图甲所示装置进行实验,并将E中收集到的气体进行如图乙所示的爆鸣实验.
(1)请帮助小明完成下表:
实验现象 | A中生成气体成分 | ||||
B中品红溶液 | D中品红溶液 | 爆鸣实验 | |||
实验一 | 98% | ________ | 不褪色 | 无爆鸣声 | 只有SO2 |
实验二 | 45% | 稍有褪色 | 不褪色 | 有爆鸣声 | ________ |
实验三 | 25% | ________ | 不褪色 | ________ | 只有H2 |
【实验结论】铁与不同浓度的硫酸反应,生成的气体产物可能不同,当硫酸溶液浓度达到足够大时,生成的气体产物中有二氧化硫.
(2)【实验结论】铁与不同浓度的硫酸反应,生成的气体产物可能不同,当硫酸溶液浓度达到足够大时,生成的气体产物中有二氧化硫
【交流反思】
(1)写出实验三中铁与硫酸溶液反应的化学方程式 ________ ,写出实验二中发生爆鸣反应的化学方程式________ .
(2)实验一中C装置的作用是________ .
【拓展延伸】小明又将A装置进行了如图所示的改进,试分析:增加的导管下端伸入液面以下原因________ ,该导管所起的作用是_________ .
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某化学兴趣小组做粗盐(含有难溶性杂质)提纯实验,并用所得的精盐配制50g5%的氯化钠溶液。
实验一:如图是同学做粗盐提纯实验的操作示意图。回答下列问题:
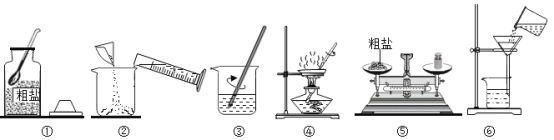
(1)操作③中用玻璃棒搅拌的作用是_____。
(2)操作⑥中的错误是_____。
(3)操作④中,当观察到____时,停止加热。
实验二:用提纯得到的精盐配制50g5%的氯化钠溶液,经检测,所配溶液溶质质量分数偏小,其原因可能有____(填序号)。①氯化钠固体仍然不纯 ②称量时砝码与精盐的位置放反 ③量取水时,俯视读数 ④配好装瓶时,有少量溶液洒出
(拓展延伸)为了除去粗盐中CaCl2、MgCl2、Na2SO4等可溶性杂质,需进行如下操作:①溶解;②依次加过量的BaCl2、NaOH、Na2CO3溶液;③过滤;④加适量盐酸;⑤蒸发、结晶。[提示:Mg(OH)2、BaSO4、BaCO3难溶于水;微溶物不形成沉淀;Na2CO3溶液呈碱性]
(1)写出加入BaCl2溶液发生反应的化学方程式____。
(2)写出加入NaOH溶液发生反应的化学方程式:____。
(3)加入过量Na2CO3溶液的目的是____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com