
将氯化钠和碳酸钠的混合物33.8g放入125g稀盐酸中,恰恰好完全反应,得氯化钠溶液150g。计算:
(1)反应后生成的CO2质量是 。
(2)反应后所得溶液中溶质质量分数为多少?(要求有计算过程)
【答案】(1)8.8g
(2)设原固体混合物中碳酸钠的质量为x,生成氯化钠的质量为y
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 117 44
x y 8.8g
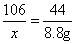
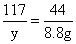
x=21.2g y=23..4g
所得溶液中溶质的质量=23.4g+(33.8g -21.2g)=36g
所得溶液中溶质的质量分数=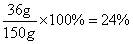
【解析】
(1)根据质量守恒定律,化学反应前后物质的总质量不变,向碳酸钠和氯化钠的固体混合物中加入稀盐酸,只是碳酸钠与盐酸反应,反应后生成了二氧化碳气体不存在于溶液中,可以求得二氧化碳的质量;
(2)要求溶液中溶质的质量分数,需要知道溶质的质量,而溶质有两部分,一部分是原有的氯化钠,一部分是生成的氯化钠。


科目:初中化学 来源: 题型:
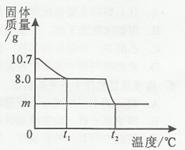
胆矾晶体部分失水后得到某硫酸铜晶体(CuSO4·xH2O),华雪同学为研究CuSO4·xH2O加热后所得物质的组成,做了以下实验:取10.7g CuSO4·xH2O晶体加热使其分解,绘制出固休的质量随温度的变化关系图。如图所示,到t1℃时该固体完全失去结晶水,化学方程式为:
CuSO4·xH2O CuSO4+ xH2O↑
CuSO4+ xH2O↑
(1)计算该硫酸铜晶体(CuSO4·xH2O)中x的值。
(CuSO4·xH2O的相对分子质量为:160+18x)
(2) CuSO4中铜元素的质量分数是多少?
(3)升温到t2℃,残留固体是黑色物质,则m= g。 (写出求m的过程)
查看答案和解析>>
科目:初中化学 来源: 题型:
菱镁矿的主要成分是MgCO3,为了分析某菱镁矿中镁元素的含量,某学习小组进行了实验研究,取10g菱镁矿,逐渐加入未知浓度的H2SO4溶液,生成的气体全部用NaOH溶液吸收,NaOH溶液增加的质量记录如下表:
| 加入H2SO4溶液的质量/g | 50 | 100 | 150 | 200 |
| NaOH溶液增加的质量/g | 2.2 | 4.4 | 4.4 | 4.4 |
说明:菱镁矿中的杂质不溶于水,不与酸发生反应。
(1)10g菱镁矿与H2SO4溶液完全反应,生成CO2的质量为 。
(2)计算该菱镁矿中镁元素的质量分数。(写出计算过程)
(3)该实验研究中所用H2SO4溶液的溶质的质量分数是 。
(4)为避免溶液排放对环境影响,某同学对上述反应后溶液进行了过滤,并在滤液中加入了1.71%的Ba(OH)2溶液。请你画出加入Ba(OH)2溶液的质量与产生沉淀的质量的关系图。(在答题卡的坐标中作图,并标出曲线折点的坐标)
查看答案和解析>>
科目:初中化学 来源: 题型:
钙是维持人体正常功能所必须的元素,有时需要服用补钙满足人体需求。下图分别为两种补钙剂说明书的一部分。

请根据图示中的信息回答下列问题:
(1)钙是人体必须的常量元素,每日要摄取足量的钙,才能避免 (填字母序号);
A.佝偻病或骨质疏松 B.贫血症 C.甲状腺肿大
(2)葡萄糖酸钙(C12H22O14Ca)的化学式量是 ;
(3)碳酸钙(化学式为CaCO3)中钙元素的质量分数为 ;
(4)每片金钙尔奇中含碳酸钙的质量为  mg;
mg;
(5)按照金钙尔奇说明书每日的补钙量,若该服用葡萄糖酸钙片,一日3次,一次应服用几片? 。
查看答案和解析>>
科目:初中化学 来源: 题型:
向154.7 g一定质量分数的稀硫酸溶液中放入10.0 g粗锌(含有不溶于稀硫酸的杂质),恰好完全反应,共收集到标准状况下的氢气2.24 L。(锌的相对原子质量为65;标准状况下氢气的密度约为0.09 g/L)
计算:(均保留1位小数)
(1)反应产生氢气的质量。
(2)反应结束后,过滤,滤渣的质量。
(3)反应后所得溶液的溶质质量分数。
查看答案和解析>>
科目:初中化学 来源: 题型:
重铬酸钾(K2Cr2O7,Mr=294。铬元素为+6价,Mr表示相对分子质量)是一种重要的化工原料,在皮革工业、有机反应中都有广泛应用。但+6价铬有很强的毒性易污染环境,使用后,须用绿矾(FeSO4·7H2O,Mr=278)将其变成低毒性+3价铬才能做后续处理.
反应原理:6FeSO4·7H2O+ K2Cr2O7+7H2SO4=3Fe2(SO4)3+Cr2(SO4)3+K2SO4+49H2O
现有1.0吨重铬酸钾需要处理,计算需要绿矾多少吨?(写出计算过程,结果精确小数点后1位)
查看答案和解析>>
科目:初中化学 来源: 题型:
气体的制备是化学实验基本技能之一。现用如下装置进行化学实验,试回答下列问题:
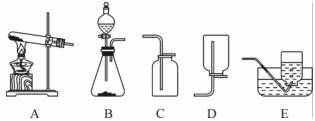
(1)实验室利用加热高锰酸钾的方法能制得氧气,则发生装置应选用______(填字母);
(2)实验室利用B装置通过复分解反应制得的气体是______,要制取一瓶该气体,所选装置的连接顺序是______(填字母);
(3)证明集气瓶中充满(2)中所制气体的方法是________________________________________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
下列说法中,正确的是( )
A.蛋白质受热或遇到浓硝酸等物质时生理活性也不会发生改变
B.无机盐是人体的主要供能物质
C.人体中缺乏钙、铁、碘元素会引起许多疾病,因此饮食中摄入的越多越好
D.提倡均衡饮食,按时进餐,不挑食、不偏食
查看答案和解析>>
科目:初中化学 来源: 题型:
溶液具有广泛的用途。根据溶液有关知识,回答下列问题:
(1)在20℃时,向盛有40g氯化钠固体的烧杯中加入100g水,充分搅拌后,仍有4g固体未溶解。
①所得溶液是20℃时氯化钠 的______溶
的______溶 液(填“饱和”或“不饱和”)。
液(填“饱和”或“不饱和”)。
②20℃时,氯化钠的溶解度为______g。
(2)现有质量分数为12%的氯化钠溶液(密度约为1.09g/cm3),配制20g质量分数为6%的氯化钠溶液。
①需要质量分数为12%的氯化钠溶液______mL(计算结果精确到0.1),需要水______mL(水的密度为1g/cm3)。
②该溶液配制过程中用到的仪器除了量筒、烧杯、玻璃棒外,还需要______。量取所需要的12%的氯化钠溶液时,应选用______(填“10mL”“20mL”或“50mL”)规格的量筒。
③把配制好的上述溶液装入______中(填“广口瓶”或“细口瓶”),盖好瓶塞并贴上标签。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com