
【题目】小明要用100g质量分数为10%的氢氧化钠溶液来制作“叶脉书签”。图12是他配制氢氧化钠溶液的实验操作示意图。
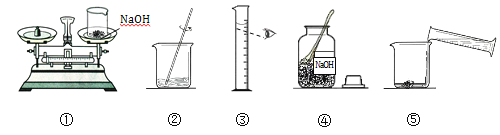
(1)量取所需要的水应选择______(选填“10mL”、“50mL”或“100mL”)量筒。
(2)指出图中的一处操作错误:__________________________________。
(3)用上述图示的序号表示配制溶液的操作顺序:______________。
(4)配制好的氢氧化钠溶液要密封保存,其原因是:_________________。
【答案】 100 mL 称量时药品和砝码颠倒(或量水时仰视读数) ④①③⑤②(或③④①⑤②) 氢氧化钠溶液与二氧化碳反应变质(或防止氢氧化钠溶液与二氧化碳反应)
【解析】根据所学知识和题中信息知,氢氧化钠质量∶100g×10%=10g 水体积∶﹙100g-10g﹚÷1g/ml=90ml。(1)量取所需要的水应选择100mL量筒,根据就近原则。(2)指出图中的一处操作错误:称量时药品和砝码颠倒(或量水时仰视读数)。(4)配制好的氢氧化钠溶液要密封保存,其原因是:氢氧化钠溶液与二氧化碳反应变质。
点睛∶量筒应根据就近原则选取量程,读数应平视;天平应左物右码;氢氧化钠溶液要密封保存。


 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:初中化学 来源: 题型:
【题目】下列图象能正确反映对应变化关系的是( )
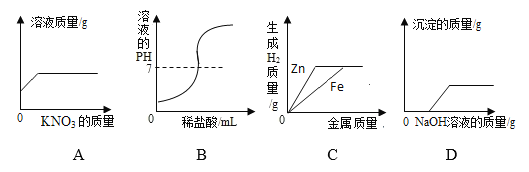
A. 在一定温度下,向不饱和的硝酸钾溶液中不断加入硝酸钾固体,充分搅拌
B. 向NaOH溶液中逐滴加入稀盐酸
C. 将一定质量的稀硫酸平均分为两份,分别向其中加入足量的金属Zn和Fe
D. 在一定量的CuSO4和HCl溶液中逐滴加入NaOH溶液
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】水在工业生产、生活以及化学实验中起着重要作用。
(1)电解水实验揭示了水的组成,反应的化学方程式为______________________,属于_______反应(填基本反应类型)。
(2)自来水厂为提高沉降效果,通常要加入絮凝剂明矾,其化学式为KAl(SO4)212H2O,明矾由________种元素组成,其中属于金属元素的是____________(写元素名称)。
(3)水在化学实验中的作用不可忽视,硫在氧气中燃烧的实验时,在集气瓶中放少量水的目的是____。
(4)下图实验证明可燃物燃烧需要与氧气接触的实验现象是__________。
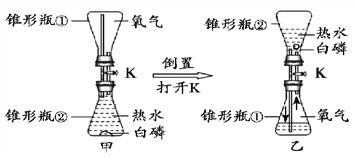
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】学习化学离不开实验.
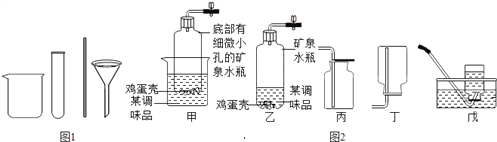
(1)小明同学在家里利用替代品进行相关实验.如:配制较多溶液时用玻璃杯代替如图1所示的仪器中的_____________(填仪器名称,下同);搅拌时用筷子代替______________.
(2)①写出实验室制取二氧化碳的化学方程式___________________.
②小明同学选用块状的鸡蛋壳和稀盐酸反应来制取二氧化碳,并利用矿泉水瓶、玻璃杯、橡皮塞、导管、止水夹等组装了如图2所示甲、乙气体发生装置.比较甲、乙装置,甲装置的优点是_________.
③选用甲装置可以进行的实验是_________________(填序号).
A.大理石和稀盐酸 B.过氧化氢溶液与二氧化锰粉末
C.粉末状的锌与稀硫酸制氢气 D.浓硫酸与甲酸共热制一氧化碳
④收集二氧化碳常选用装置___________(填编号,下同);若收集氨气应选用装置_____(已知氨气极易溶于水,密度比空气小).
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】钢铁是重要的金属材料,在工农业生产和生活中应用非常广泛。
I.铁的应用
(1)下列铁制品的利用与金属导热性有关的是_________________
A.铁钳 B.铁锅 C.刀具
(2)“纳米α-Fe粉”可以用于食品保鲜,称之为“双吸剂”,因为它能吸收空气中的_______。
II.铁的冶炼
工业炼铁的原理是高温下用CO作还原剂,将铁从氧化物中还原出来。请回答下列问题:
(1)写出以赤铁矿为原料,在高温下炼铁的化学方程式:______________;
(2)高炉炼铁中,焦炭的作用除了可以生成一氧化碳外,还能____________。
Ⅲ.铁的活动性探究
现用一定量的AgNO3和Cu (NO3)2混合溶液,进行了如下图所示的实验,并对溶液A和固体B的成分进行了分析和研究.
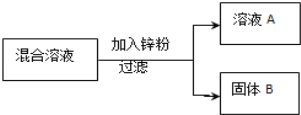
【提出问题】溶液A中的溶质可能有哪些?
【作出猜想】
①只有Zn(NO3)2
②有Zn(NO3)2、AgNO3
③有Zn(NO3)2、Cu(NO3)2
④有Zn(NO3)2、Cu(NO3)2、AgNO3
【交流讨论】不合理的猜想是_______(填标号),其理由是__________
【实验探究】根据如表中的实验步骤及现象,完成表中的实验结论
实验步骤 | 现象 | 实验结论 |
取少量固体B,滴加稀盐酸 | 有气泡产生 | 溶液A中的溶质成分符合猜想__, 固体B中的金属成分有________种. |
Ⅳ.生铁中铁含量的测定
某课外兴趣小组测定生铁(含杂质的铁,杂质既不溶于水也不溶于酸)中铁的质量分数,他们取五份样品,分别加稀硫酸反应.测得部分数据如下,请根据有关信息回答问题.
实验次数 | 1 | 2 | 3 | 4 | 5 |
取样品质量(g) | 30.0 | 30.0 | 30.0 | 30.0 | 30.0 |
取稀硫酸质量(g) | 50.0 | 100.0 | 150.0 | 200.0 | 250.0 |
产生气体质量(g) | 0.2 | a | 0.6 | 0.8 | 0.9 |
(1)a的数值为_______________.
(2)第5次实验结束后,所得到溶液中溶质的化学式为_________________.
(3)列式计算该样品中单质铁的质量分数是______________。
(4)所用稀硫酸的溶质的质量分数为____________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下图是对20 ℃一定质量的甲的溶液进行恒温蒸发结晶的实验过程,下列说法正确的是
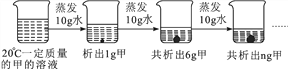
A. 蒸发前原溶液是饱和溶液
B. n的数值是12
C. 甲物质在20 ℃时的溶解度是50 g
D. 甲物质的溶解度随温度的升高而增大
查看答案和解析>>
科目:初中化学 来源: 题型:
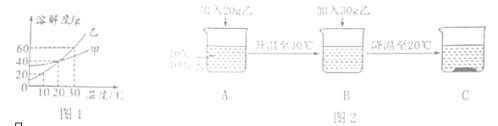
【题目】图1为甲、乙两种物质(均不含结晶水)的溶解度曲线图。请回答下列问题。
(1)在10℃时,甲的溶解度 乙的溶解度,(选填“>”“<”或“=”)
(2)在20℃时,向盛有50g水的烧杯中加入25g甲物质,充分搅拌后溶液质量是 g。
(3)取乙进行如图实验,属于饱和溶液的是 ,溶质质量分数最大的是 。(选填字母序号)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】在2017年的“世界环境日”,我国提出以“绿水青山就是金山银山”为主题,这一主题的提出旨在动员、引导人们尊重自然、顺应自然、保护自然以实现“共建美丽中国”的愿景。水资源的保护显得尤其重要:
(1)天然水中含有许多杂质,要分离出水中的不溶性杂质,通常选择_____________(选填“过滤”或“蒸发”)的方法。在该操作中用到的玻璃仪器,除了漏斗、烧杯外还需要_________________,该仪器在该操作中的作用是_______________;除此之外净化水的方法还有:① 活性炭层吸附 ②蒸馏 ③加明矾吸附沉降 ④消毒杀菌等,其中净化程度最高的是 ______________(填序号)。
(2)天然水多为硬水,硬水给生活和生产带来很多麻烦,生活中常用_________来降低水的硬度。
(3)要把天然水净化成生活用的自来水,多用漂白粉来杀菌消毒,其有效成分是次氯酸钙[化学式为Ca(ClO)2]。次氯酸钙可发生如下反应:Ca(ClO)2+ X+H2O=CaCO3↓+2HClO, 则X的化学式为_________。
(4)工业生产中,很多化学反应都需要在溶液中才能进行。水是配制溶液时最常用的溶剂,某同学按照下图中的C的方式观察量取水的体积,则所配制溶液的溶质质量分数会______________(选填“偏大”“偏小”或“无影响”)

(5)在溶液的配制过程中,准确称量固体物质也是配制的关键。某同学要用托盘天平称量13.5g食盐,他在天平右盘上加上10g砝码并将游码移到3.5g位置,当左盘加入一定量的食盐后发现指针偏向左边,这时他应该____________(填字母序号)
A.增加砝码 B.移动游码 C.增加药品 D.减少药品
(6)请结合生活实际,提出一条节水措施______________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
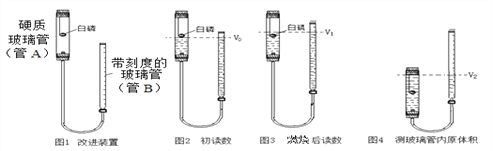
【题目】用图1装置(夹持装置已略去)测定空气中氧气的含量。已知:①白磷的着火点为40℃;②带刻度玻璃管从上往下读数增大
Ⅰ. 实验步骤
(1)检查图1装置的气密性:往图1装置管B中加适量的水,塞紧管A上端的橡皮塞,调整带刻度玻璃管的高度,使管B内液面高于另一侧液面,过一段时间,当观察到_________现象,说明装置气密性良好。
(2)如图2所示,将稍过量的白磷放入燃烧匙,塞紧橡胶塞,调整管A与带管B内液面于同一水平线,读取带刻度玻璃管内视数V0。
(3)用激光笔点燃白磷,可观察到管A内现象是_________,待冷却至室温,调整管A与管B内液面处于同一水平线,读取管A内视数V1(如图3所示)。
(4)如图4所示,打开管A上端橡胶塞,将管A位置下移,管B上移,至管A中充满水,立即再塞紧上端橡胶塞,调整管A与管B内液面处于同一水平线,读取带管B内视数V2。
Ⅱ. 数据记录与处理
(5)某次实验记录数据如下表,请根据数据计算并填写表中空格。
V0/mL | V1/mL | V2/mL | V(O2)/ mL | V(空气)/ mL | 空气中氧气含量 (用数值列式即可) |
1.87 | 8.02 | 31.60 | ① ___ | ②____ | ③ ______ |
重复3次实验,计算出空气中氧气含量的平均值。
Ⅲ. 实验评价
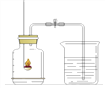
(6)与教材实验(如下图所示)比较,本实验的优点是______________(写一条)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com