
| A. | CO | B. | O2 | C. | CO2 | D. | N2 |
科目:初中化学 来源: 题型:计算题
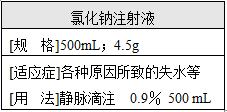 如图是给病人输液用的氯化钠注射液的标签,请根据该标签提供的信息回答:要配制1000mL这种注射溶液(密度为1g/cm3),需氯化钠多少克?
如图是给病人输液用的氯化钠注射液的标签,请根据该标签提供的信息回答:要配制1000mL这种注射溶液(密度为1g/cm3),需氯化钠多少克?查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 通常状况下,氧气是一种无色无味的气体 | |
| B. | 氧气不易溶于水 | |
| C. | 氧气在低温高压时能变成淡蓝色液体或固体 | |
| D. | 氧气的化学性质:具有可燃性 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
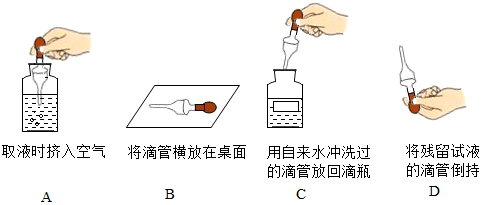
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
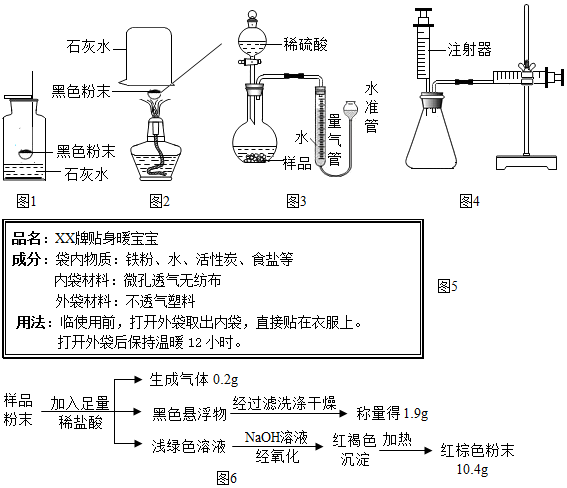
| 实验操作 | 实验现象 | 解释或结论 | |
| 步骤1 | 取A、B两袋“暖宝宝”,将A袋按使用说明打开外袋取出内袋;而B袋不打开外袋.并将两袋样品放置在同样的环境中. | A袋的“暖宝宝”温度很快上升;B袋温度. | “暖宝宝”发热是由于袋内物质与O2(或空气)接触. |
| 步骤2 | 24小时后,分别剪开A、B两袋,各取少量袋内物质于两支试管中,分别加入适量稀盐酸. | A袋内物质部分溶解,产生黄色溶液;B袋内物质. | 用化学方程式表示产生黄色溶液的反应:Fe2O3+6HCl=2FeCl3+3H2O |
| 【得出结论】:“暖宝宝”发出的热量主要来自铁粉发生氧化(生锈)的过程. | |||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com