实验室里现有一包氯化镁和氯化钠的固体混合物样品,某同学取该样品12.8g,使之完全溶解在53g水中,再向其中加入40g 20%的氢氧化钠溶液,氯化镁和氢氧化钠恰好完全反应MgCl2+2NaOH=Mg(OH)2↓+2NaCl,反应后过滤.求:
(1)12.8g样品中氯化镁的质量;
(2)所得滤液中氯化钠的质量分数.
【答案】
分析:(1)先算出氢氧化钠的质量,然后写出化学方程式并计算出氯化镁的质量.
(2)由(1)计算出氢氧化镁沉淀的质量和生成的氯化钠的质量.然后计算质量分数.
解答:解:(1)氢氧化钠的质量=40克×20%═8克,设需要氯化镁的质量是X,生成的氢氧化镁的质量是Y,生成的氯化钠的质量是Z.
MgCl
2+2NaOH=Mg(OH)
2↓+2NaCl
95 80 58 117
X 8克 Y Z
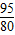
═
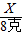
得:X=9.5克
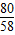
═
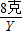
得:Y=5.8克
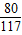
═
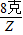
得:Z=11.7克
(2)滤液中溶质(氯化钠)的质量=(12.8克-9.5克)+11.7克=15克,溶液的质量=12.8克+53克+40克-5.8克=100克,则溶液中溶质的质量分数=
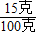
×100%═15%.
答:12.8g样品中氯化镁的质量为9.5克;所得滤液中氯化钠的质量分数为15%.
点评:掌握化学方程式的计算格式和规范性,注意滤液中溶液和溶质的质量的计算.

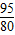 ═
═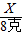
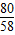 ═
═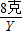
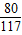 ═
═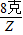
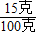 ×100%═15%.
×100%═15%.

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案