
 =
=
 ×100%计算即可。
×100%计算即可。 =
=
 ×100%=14.0%
×100%=14.0% 

科目:初中化学 来源:不详 题型:计算题

查看答案和解析>>
科目:初中化学 来源:不详 题型:计算题
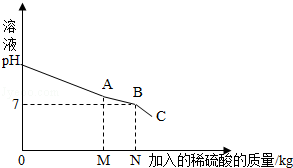
查看答案和解析>>
科目:初中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:初中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:初中化学 来源:不详 题型:计算题
| 时间/min | t1 | t2 | t3 | t4 | t5 | t6 |
| 烧杯中剩余物质的总质量/g | 28.35 | 28.1 | 27.85 | 27.6 | 27.5 | 27.5 |
查看答案和解析>>
科目:初中化学 来源:不详 题型:计算题
| | 部分性质 | 生理作用 |
| 维生素C 化学式:C6H806 | 无色晶体,易溶于水;在酸性溶液中稳定,中性或碱性溶液中易被空气氧化…… | 促进人体生长发育,增强人体对疾病的抵抗能力…… |
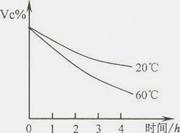
查看答案和解析>>
科目:初中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:初中化学 来源:不详 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com