
 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案科目:初中化学 来源: 题型:选择题
| A. | 粗盐提纯实验中,蒸发结晶直到滤液蒸干时停止加热 | |
| B. | B用湿润的PH试纸准确测得某地雨水的PH为4.6 | |
| C. | 用适量的水能区分硝酸铵固体和氢氧化钠固体 | |
| D. | 只需滴加无色酚酞试液就能区分氢氧化钠和碳酸钠溶液 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
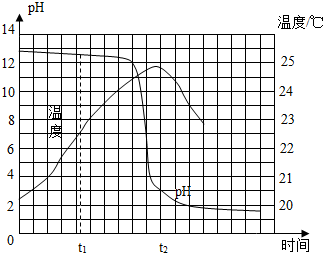 兴趣小组的同学为研究酸和碱反应的特点,将稀盐酸匀速、缓慢地滴入盛有氢氧化钠溶液的烧杯中,并测绘出烧杯内溶液的温度和pH的变化图象(如图所示),请回答问题:
兴趣小组的同学为研究酸和碱反应的特点,将稀盐酸匀速、缓慢地滴入盛有氢氧化钠溶液的烧杯中,并测绘出烧杯内溶液的温度和pH的变化图象(如图所示),请回答问题:| 主要成分 | 主要成分的相对分子质量 | 建议每次服用剂量/g |
| Al(OH)3 | 78 | 0.25 |
| NaHCO3 | 84 | 0.5 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验操作 | 预计实验现象 | 实验结论及解释 |
| ①将少量所得精盐溶于水,滴加少量稀NaOH溶液 | 出现白色沉淀 | 所得精盐中可能含有氯化镁. 化学方程式MgCl2+2NaOH═Mg(OH)2↓+2NaCl |
| ②取实验①中的上层清液继续滴加NaOH溶液至不再有沉淀时,在上层清液中再滴加碳酸钠溶液 | 出现白色沉淀 | 所得精盐中可能含有氯化钙 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 分解反应 | B. | 化合反应 | C. | 置换反应 | D. | 复分解反应 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

| 0℃ | 20℃ | 40℃ | 60℃ | 80℃ | 100℃ | |
| NaCl(g) | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 | 39.8 |
| KNO3(g) | 13.3 | 31.6 | 63.9 | 110 | 169 | 246 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

| 实验序号 | 实验现象 | 实验结论 |
| A | 剧烈反应,急速产生大量气泡,试管外壁发烫 | 反应速率过快,气体不便收集,不适合实验室制取氢气 |
| B | 缓慢产生大量气泡 | 反应速率过慢,不适合实验室制取氢气 |
| C | 较快产生大量气泡,试管外壁发热 | 反应速率适中,适用于实验室制取氢气 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com