
| 实验过程 | 实验现象 | 实验结论 |
| 向盛有少量Fe2CO3的试管中分别加入NaCl溶液和Na2SO4溶液,振荡 | 固体不溶解 | ${SO}_{4}^{2-}$或Cl-不能使Fe2O3溶解;H2O分子不能使Fe2O3溶解 |
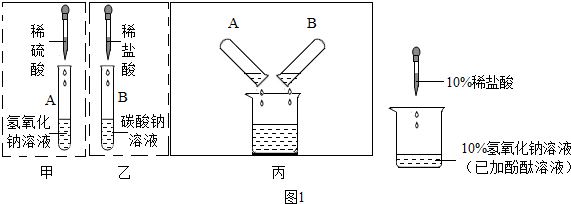
分析 (1)酸溶液和金属氧化物发生反应的实质是酸中的氢离子和金属氧化物中的氧离子结合生成水的过程,用盐酸可以清除铁锈,是因为盐酸中的氢离子使氧化铁溶解了,而不是盐酸中的水分子和氯离子.
(2)废液缸中有气泡产生,说明液体中有酸和碳酸根;所以知A试管含有Na2SO4、H2SO4溶;B试管中含有NaCl、Na2CO3;
根据碳酸钠和硫酸反应生成硫酸钠、水和二氧化碳解答;
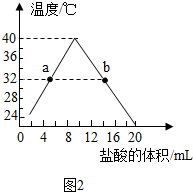
(3)①根据到达b点的温度变化来分析;②根据氢氧化钠的性质来分析;
(4)根据金属活动性可知,金属铜不能与稀硫酸发生反应,而锌与稀硫酸放出氢气;固体质量不再减少,可判断锌已完全反应,反剩余固体为不能反应的铜;混合物粉末的质量与铜的质量差即反应所消耗锌的质量,利用该质量计算出反应所消耗硫酸的质量,利用硫酸质量与所加稀硫酸质量比完成所用稀硫酸的溶质质量分数的计算.
解答 解:(1)①由于真正使氧化铁溶解的是硫酸、盐酸中的氢离子,而不是硫酸中水分子和硫酸根离子,盐酸中的水分子和氯离子,故答案为:${SO}_{4}^{2-}$或Cl-不能使Fe2O3溶解;H2O分子不能使Fe2O3溶解;
②由于NaCl溶液和Na2SO4溶液中本身就有水,故不需要,因为上面的实验中,NaCl溶液和Na2SO4溶液里已经含有水.
(2)①废液缸中有气泡产生,通过反应可知:①硫酸和氢氧化钠溶液生成硫酸钠和水,②盐酸和碳酸钠生成氯化钠和水和二氧化碳;另外还应考虑硫酸和碳酸钠过量;所以知A试管含有Na2SO4、H2SO4;B试管中含有NaCl、Na2CO3;
②在丙所示实验过程中有气体产生,是碳酸钠和硫酸反应生成硫酸钠、水和二氧化碳,此反应的化学方程式为:Na2CO3+H2SO4═Na2SO4+H2O+CO2↑;
(3)①b点的温度是由高到低的趋势,说明是中和反应恰好完成后,继续滴加稀盐酸到过量,故填:酸性;
②当溶液温度为38℃时,可证明溶液中氢氧化钠已经不存在的实验现象是往烧杯中再滴加少量氢氧化钠溶液并观察瞬间溶液颜色变化,若先变红,后变无色,证明其中没有氢氧化钠.
(4)混合物中金属锌的质量=10g-3.5g=6.5g
设49g稀硫酸中溶质H2SO4的质量为x
Zn+H2SO4═ZnSO4+H2↑
65 98
6.5g x
$\frac{65}{6.5g}=\frac{98}{x}$
x=9.8g
所用稀硫酸的溶质质量分数=$\frac{9.8g}{49g}×$100%=20%
答案:
(1)①${SO}_{4}^{2-}$或Cl-不能使Fe2O3溶解;H2O分子不能使Fe2O3溶解;
②NaCl溶液和Na2SO4溶液里已经含有水.
(2)①Na2SO4、H2SO4;NaCl、Na2CO3;
②Na2CO3+H2SO4═Na2SO4+H2O+CO2↑;
(3)①酸性;②溶液由红色变为无色;
(4)所用的稀硫酸中溶质的质量分数是20%.
点评 本题主要考查化学实验方案的设计与评价,根据物质的性质和物质间的反应规律,学会运用猜想与事实验证的方法和技巧处理实验问题.解答此题的关键是只需要对所涉及的各个反应中反应物是否恰好完全反应做出假设,若反应物恰好完全反应,则废液中的溶质只有生成物,若反应结束后反应物仍有剩余,则废液中的溶质除了生成物外还有剩余的反应物.


科目:初中化学 来源: 题型:选择题
| A. | 夏天食物腐烂与氧气无关 | |
| B. | 鱼、虾等能在水中生存,是由于氧气极易溶于水 | |
| C. | 可燃物接触氧气就能够燃烧 | |
| D. | 氧气供给呼吸,它和体内物质反应,释放能量,维持生命活动的需要 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | “石头纸”比普通纸更坚固 | B. | “石头纸”比普通纸更易燃 | ||
| C. | “石头纸”比普通纸更环保 | D. | 可用稀盐酸区别“石头纸”与普通纸 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 实验步骤 | 实验现象 | 实验结论 |
| 样品为铵态氮肥 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
 实验中,小红误将氢氧化钠溶液当成酸滴加到金属铝中,结果发现也有气泡产生,为了解该气体的成分,实验小组进行了以下探究
实验中,小红误将氢氧化钠溶液当成酸滴加到金属铝中,结果发现也有气泡产生,为了解该气体的成分,实验小组进行了以下探究查看答案和解析>>
科目:初中化学 来源: 题型:解答题
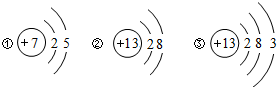 在宏观、微观和符号之间建立联系是化学学科的特点.
在宏观、微观和符号之间建立联系是化学学科的特点.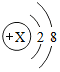 ,若该粒子带有1个单位负电荷,则X=9.
,若该粒子带有1个单位负电荷,则X=9.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com