
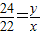
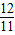 x
x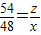 ,
, x
x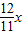 :
: x=32:33
x=32:33

 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案科目:初中化学 来源: 题型:阅读理解
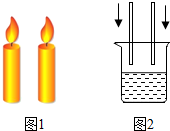 (2012?海淀区一模)在户外聚会时,化学老师点燃了一支自制的蜡烛,如图1,同学们发现这支蜡烛不易被风吹灭,原来在蜡烛的棉芯里藏了两根相互缠绕的银白色金属丝.老师指出金属丝的成分可能是Mg、Al、Fe中的一种或两种.回校后,老师提供了Mg、Al、Fe三种已知金属和MgSO4、Al2(SO4)3、FeSO4、CuSO4四种盐溶液,以及未知金属的样品.指导同学们先进行了参照实验,之后探究未知金属的成分.
(2012?海淀区一模)在户外聚会时,化学老师点燃了一支自制的蜡烛,如图1,同学们发现这支蜡烛不易被风吹灭,原来在蜡烛的棉芯里藏了两根相互缠绕的银白色金属丝.老师指出金属丝的成分可能是Mg、Al、Fe中的一种或两种.回校后,老师提供了Mg、Al、Fe三种已知金属和MgSO4、Al2(SO4)3、FeSO4、CuSO4四种盐溶液,以及未知金属的样品.指导同学们先进行了参照实验,之后探究未知金属的成分.| 试剂 | Mg | Al | Fe |
| MgSO4溶液 | 有气泡产生. | ▲ | ▲ |
| Al2(SO4)3溶液 | 有大量气泡产生,一段时间后金属表面有白色固体附着. | ▲ | ▲ |
| FeSO4溶液 | 有大量气泡产生,一段时间后金属表面有灰黑色固体附着. | 试管底部有灰黑色固体析出. | ▲ |
| CuSO4溶液 | 有大量气泡产生,一段时间后金属表面有红色固体附着. | 一段时间后金属表面有红色固体附着. | 一段时间后金属表面有红色固体附着. |
| 试剂 | 两根未知金属丝 |
CuSO4溶液 |
一根金属丝上有大量气泡产生,另一根金属丝上没有气泡;一段时间后,两根金属丝表面都有红色固体附着. |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解

| 试剂 | Mg | Al | Fe |
| MgSO4溶液 | 有气泡产生. | ▲ | ▲ |
| Al2(SO4)3溶液 | 有大量气泡产生,一段时间后金属表面有白色固体附着. | ▲ | ▲ |
| FeSO4溶液 | 有大量气泡产生,一段时间后金属表面有灰黑色固体附着. | 试管底部有灰黑色固体析出. | ▲ |
| CuSO4溶液 | 有大量气泡产生,一段时间后金属表面有红色固体附着. | 一段时间后金属表面有红色固体附着. | 一段时间后金属表面有红色固体附着. |
| 试剂 | 两根未知金属丝 |
CuSO4溶液 |
一根金属丝上有大量气泡产生,另一根金属丝上没有气泡;一段时间后,两根金属丝表面都有红色固体附着. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com