
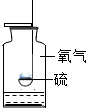
 小明同学在中考实验专项复习时发现一些燃烧实验常在容器中放少量的水,但作用各不相同.请你回答:硫在氧气中燃烧的实验,瓶中装少量水的作用是什么?
小明同学在中考实验专项复习时发现一些燃烧实验常在容器中放少量的水,但作用各不相同.请你回答:硫在氧气中燃烧的实验,瓶中装少量水的作用是什么? 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
 科学家经过多年研究证明,有一些同学爱吃的小包装零食中,含一定量的有毒、有害、致病的化学物质,如某些油炸食品中含有致癌物质丙烯酰胺(C3H5ON),经测定如图产品中含丙烯酰胺(C3H5ON)的质量分数为0.02%.
科学家经过多年研究证明,有一些同学爱吃的小包装零食中,含一定量的有毒、有害、致病的化学物质,如某些油炸食品中含有致癌物质丙烯酰胺(C3H5ON),经测定如图产品中含丙烯酰胺(C3H5ON)的质量分数为0.02%.查看答案和解析>>
科目:初中化学 来源: 题型:
| 1 |
| 10 |
查看答案和解析>>
科目:初中化学 来源: 题型:

查看答案和解析>>
科目:初中化学 来源: 题型:

查看答案和解析>>
科目:初中化学 来源: 题型:
 2010年上海世博会的主题是“城市,让生活更美好”.
2010年上海世博会的主题是“城市,让生活更美好”.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com