
| A. | KNO3 FeCl3 KOH H2SO4 | B. | NH4HCO3 Ba(OH)2 H2SO4 NaNO3 | ||
| C. | NaCl MgCl2 K2SO4 CuSO4 | D. | K2CO3 Na2SO4 BaCl2 NaOH |
分析 在不另加试剂就能鉴别的题目中,首先观察有无有特殊颜色的物质,若有,将有颜色的溶液鉴别出来,然后再借用这种溶液鉴别其它溶液把其它没有确定出的物质确定出来;若都没有颜色就将溶液两两混合,根据混合后的现象进行分析鉴别.
解答 解:A、FeCl3溶液是黄色的,能与FeCl3溶液反应产生红褐色沉淀的是的是KOH溶液,再将剩余的两种溶液分别滴加至红褐色沉淀中,能使沉淀消失的是H2SO4,无明显变化的是KNO3溶液,故不加其他试剂可以鉴别.
B、组内四种物质的溶液两两混合时,其中有一种溶液与其它三种溶液混合时出现一次白色沉淀和一次放出气体,该溶液为H2SO4;与H2SO4产生气体的溶液为NH4HCO3,产生白色沉淀的为Ba(OH)2;与碳酸钠溶液混合无任何明显现象的为NaNO3溶液;故不加其他试剂可以鉴别.
C、CuSO4溶液是蓝色的,但其余两两混合均没有明显象,故不加其他试剂无法鉴别.
D、BaCl2与K2CO3、Na2SO4反应生成碳酸钡、硫酸钡白色沉淀,但其余两两混合均没有明显象,故不加其他试剂无法鉴别.
故选:AB.
点评 解答不另加试剂就能鉴别的题目时,若选项中有带色的离子,首先鉴别,然后再鉴别其它的物质;若都没有颜色,可将溶液两两混合,根据混合后的现象进行鉴别.


科目:初中化学 来源: 题型:实验探究题
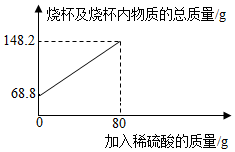 为测定某碳素钢样品中铁的质量分数,现取一定质量的样品粉末于质量为51.8g的烧杯中,然后逐步加入一定质量分数的稀硫酸,当加入80g稀硫酸时反应恰好完全,加入稀硫酸的质量与烧杯及烧杯内物质的总质量的关系如图.试通过计算完成下列填空:(不能整除时,结果保留一位小数)
为测定某碳素钢样品中铁的质量分数,现取一定质量的样品粉末于质量为51.8g的烧杯中,然后逐步加入一定质量分数的稀硫酸,当加入80g稀硫酸时反应恰好完全,加入稀硫酸的质量与烧杯及烧杯内物质的总质量的关系如图.试通过计算完成下列填空:(不能整除时,结果保留一位小数)查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | ①④⑤ | B. | ①③ | C. | ③④⑤ | D. | ①②③ |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 紫色石蕊试液 | B. | 锌粒 | C. | 碳酸钠溶液 | D. | 稀盐酸 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
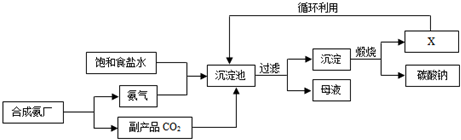
| A. | 沉淀池中的反应物只有两种 | |
| B. | 物质X是氨气,它可以循环使用 | |
| C. | 沉淀为碳酸钙 | |
| D. | 通入氨气的作用是使溶液呈碱性,促进二氧化碳的吸收,更多地析出沉淀 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com