美国化学家西博格说:化学是人类进步的关键.
(1)化学知识在生产实际中有着广泛的用途,请用化学方程式表示下列应用:
①古代用“湿法冶金”的方法炼铜______;
②用氢氧化铝治疗胃酸过多______;
③用稀盐酸取出热水瓶中水垢(主要成分为碳酸钙)______.
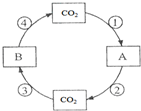
(2)为减少“温室效应”带来的负面影响,法国化学家Paul Sabatier提出CO2甲烷反应.该反应使CO2和H2在催化剂作用下生成CH4和H2O,试写出该反应的化学方程式______.
(3)在纳米ZnFe2O4的催化作用下,太阳光将水分解为氢气与氧气.写出该反应的化学方程式:______,该反应中将______能转化为氢能.
(4)在温度超过374℃、压强超过22.1MPa下的水是超临界水.用超临界水、空气氧化处理聚氯乙烯[化学式为(C2H3Cl)n]的反应中,生成HCl和两种无污染的氧化物______、______(写化学式).
解:(1)①湿法炼铜就是用金属铁与铜的盐溶液反应,即铁与硫酸铜溶液反应,生成铜和硫酸亚铁,反应的化学方程式为:Fe+CuSO
4=FeSO
4+Cu;
②因为氢氧化铝是碱,胃酸的主要成分是盐酸,所以氢氧化铝治疗胃酸过多是氢氧化铝和盐酸发生中和反应,反应的化学方程式为:Al(OH)
3+3HCl=AlCl
3+3H
2O;
③水垢的主要成分是CaCO
3,CaCO
3能与酸反应生成二氧化碳,所以可以用稀盐酸酸除水垢,反应的化学方程式为:CaCO
3+2HCl=CaCl
2+H
2O+CO
2↑;
(2)反应使CO
2和H
2在催化剂作用下生成CH
4和H
2O,反应的化学方程式为:CO
2+4H
2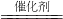
CH
4+2H
2O;
(3)根据在纳米ZnFe
2O
4的催化作用下,太阳光将水分解为氢气与氧气的化学方程式为:2H
2O

2H
2↑+O
2↑;该反应中是将太阳能能转化为氢能;
(4)根据题给信息知参加反应的物质中含有C、H、O、Cl四种元素,生成HCl和两种无污染的氧化物;再根据质量守恒定律的实质可知,反应前后元素的种类不变,写出两种无污染的氧化物化学式分别为:CO
2和H
2O.
故答案为:(1))①Fe+CuSO
4=FeSO
4+Cu;
②Al(OH)
3+3HCl=AlCl
3+3H
2O;
③CaCO
3+2HCl=CaCl
2+H
2O+CO
2↑;
(2)CO
2+4H
2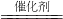
CH
4+2H
2O;
(3)2H
2O

2H
2↑+O
2↑,太阳;
(4)CO
2、H
2O.
分析:(1)①用铁和硫酸铜发生置换反应;②氢氧化铝和胃酸发生中和反应;③利用盐酸和碳酸钙反应生成二氧化碳分析;
(2)根据题目中CO
2和H
2在催化剂作用下生成CH
4和H
2O来写反应的化学方程式;
(3)根据在纳米ZnFe
2O
4的催化作用下,太阳光将水分解为氢气与氧气的信息写出该反应的化学方程式;
(4)根据题给信息和质量守恒定律的实质写出相关的化学式.
点评:此题主要考查根据题目给的信息和遵循质量守恒定律写出相应的化学方程式及相关的化学式,此题能培养学生的化学用语的应用能力.

 CH4+2H2O;
CH4+2H2O; 2H2↑+O2↑;该反应中是将太阳能能转化为氢能;
2H2↑+O2↑;该反应中是将太阳能能转化为氢能;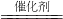 CH4+2H2O;
CH4+2H2O; 2H2↑+O2↑,太阳;
2H2↑+O2↑,太阳;

 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案 小题狂做系列答案
小题狂做系列答案