
| A. | 在硫酸中;Ba2+、CO32-、Zn2+ | B. | 在pH大于7的溶液中;H+、Mg2+、Cl-、 | ||
| C. | 在氯化钠溶液中;K+、Ca2+、NO3- | D. | 在硫酸铵溶液中;Na+、Cu2+、OH- |
分析 根据复分解反应的条件,离子间若能互相结合成沉淀、气体或水,则离子不能共存,据此进行分析判断即可.
解答 解:A、在稀硫酸中,稀硫酸中的氢离子能与CO32-结合生成水和二氧化碳,Ba2+能与SO42-结合生成硫酸钡沉淀,不能大量共存,故选项错误.
B、pH大于7的溶液中显碱性,溶液中含有氢氧根离子,OH-与H+、Mg2+能结合生成水、氢氧化镁沉淀,不能大量共存,故选项错误.
C、在氯化钠溶液中含有钠离子和氯离子,钠离子、氯离子、K+、Ca2+、NO3-五种离子间不能结合成沉淀、气体或水,能在氯化钠溶液中大量共存,故选项正确.
D、在硫酸铵溶液中,NH4+、OH-两种离子能结合成氨气和水;铜离子和OH-两种离子能结合成氢氧化铜沉淀,不能大量共存,故选项错误.
故选:C.
点评 本题考查了离子共存的问题,判断各离子在溶液中能否共存,主要看溶液中的各离子之间能否发生反应生成沉淀、气体、水.


科目:初中化学 来源: 题型:选择题
| A. | 为防治佝偻病,可适量补钙 | |
| B. | 食用富含维生素D的鱼肝油,可降低细胞老化的速度 | |
| C. | 人误食重金属盐中毒后,可服用蛋清解毒 | |
| D. | 糖类食品能为人体提供能量,剩余部分在体内可转化为脂肪 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
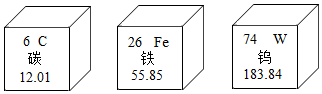 近日,我国企业成功研发圆珠笔笔头用新型不锈钢材料,标志着笔头用材料的国产化、自主化进程迈出了关键一步.笔头不锈钢材料中含有碳、铁、钨等元素.如图是其元素的部分信息( )
近日,我国企业成功研发圆珠笔笔头用新型不锈钢材料,标志着笔头用材料的国产化、自主化进程迈出了关键一步.笔头不锈钢材料中含有碳、铁、钨等元素.如图是其元素的部分信息( )| A. | 碳元素只能形成二种单质 | |
| B. | 铁是地壳中含量最多的金属元素 | |
| C. | 一个钨原子的质量为183.84g | |
| D. | 碳、铁、钨的原子核外电子数依次增加 |
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
 甲、乙、丙、丁均为中学化学中的常见物质,其中甲是大理石的主要成分,乙是造成温室效应的主要气体,它们之间的转化关系如图所示.请根据相关信息回答问题:
甲、乙、丙、丁均为中学化学中的常见物质,其中甲是大理石的主要成分,乙是造成温室效应的主要气体,它们之间的转化关系如图所示.请根据相关信息回答问题:查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 硫在空气中燃烧发出蓝紫色火焰 | |
| B. | 蜡烛在空气中燃烧生成水和二氧化碳 | |
| C. | 红磷燃烧产生大量白雾 | |
| D. | 木炭在氧气中燃烧发白光 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com