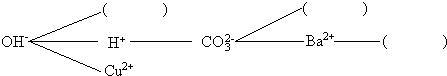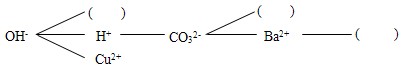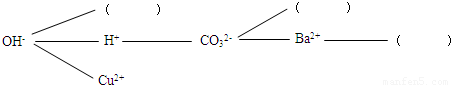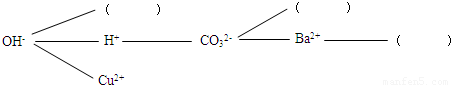实验中学同学开展复分解反应研究性学习,设计了如下研究性学习思路:
【练习质疑】下列各组物质间均能反应,写出③、④反应的化学方程式.
①氢氧化钠溶液与盐酸 ②碳酸钠溶液与硫酸
③硫酸铜溶液和氢氧化钠溶液________.
④碳酸钠溶液和氯化钡溶液________.
【研究讨论】上述反应为什么能够发生?是因为这些反应物中含有特殊的阴、阳离子,如①中有H+和OH-,②中有H+和CO32-,③中有________,④中有________.
【拓展运用】通过以上分析可以判断化合物间能否共存,进行物质的鉴别,用于物质的除杂等.如硫酸钠溶液混有碳酸钠,可以加入________(填写化学式)除去碳酸钠.
2NaOH+CuSO4=Cu(OH)2↓+Na2SO4 Na2CO3+BaCl2═BaCO3↓+2NaCl OH-和Cu2+ CO32-和Ba2+ H2SO4
分析:【练习质疑】根据复分解反应发生的条件:生成物中有沉淀、气体或水生成,写出反应的化学方程式即可.
【研究讨论】复分解反应的实质是:发生复分解反应的两种物质在水溶液中相互交换离子,结合成沉淀、气体、水.
【拓展运用】除杂质题至少要满足两个条件:①加入的试剂只能与杂质反应,不能与原物质反应;②反应后不能引入新的杂质.
解答:【练习质疑】③硫酸铜溶液和氢氧化钠溶液生成氢氧化铜沉淀和硫酸钠,反应的化学方程式为:2NaOH+CuSO4=Cu(OH)2↓+Na2SO4.
④碳酸钠溶液和氯化钡溶液反应生成碳酸钡沉淀和氯化钠,反应的化学方程式为:Na2CO3+BaCl2═BaCO3↓+2NaCl.
【研究讨论】复分解反应实际参加反应的离子是能结合成沉淀、气体或水的离子,所以③中反应生成氢氧化铜沉淀,是氢氧根离子与铜离子;④中反应生成碳酸钡沉淀,是碳酸根离子与钡离子.
【拓展运用】要除去硫酸钠溶液中的碳酸钠,实质就是除去碳酸根离子,可利用碳酸钠溶液与稀硫酸反应生成硫酸钠、水和二氧化碳,能除去杂质且没有引入新的杂质,符合除杂原则.
故答案为:【练习质疑】③2NaOH+CuSO4=Cu(OH)2↓+Na2SO4;④Na2CO3+BaCl2═BaCO3↓+2NaCl;
【研究讨论】OH-和Cu2+;CO32-和Ba2+;
【拓展运用】H2SO4.
点评:本题难度不大,掌握复分解反应的实质、化学方程式的书写、抓住除杂质的必需条件(加入的试剂只与杂质反应,反应后不能引入新的杂质)是正确解题的关键.



 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案