
【题目】现有HCl与BaCl2的混合溶液,为了分析混合溶液中HCl和BaCl2的质量分数,设计了如下实验方案(假设反应都是充分完全):
(实验数据)实验共记录了两组数据:第①组,气体吸收完全后,NaOH溶液质量增加4.4g;第②组,沉淀完全后,经过滤、洗涤、烘干后得到固体的质量为19.7g。根据实验设计及有关数据进行分析与计算:(结果均保留0.1%)
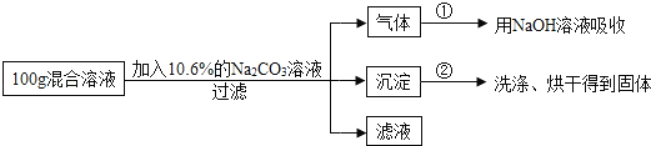
(1)混合溶液中BaCl2的质量分数为多少?
(2)若实验中混合溶液与Na2CO3溶液恰好完全反应,经过滤后所得滤液的质量为多少?
【答案】20.8%;275.9g
【解析】
解:(1)设氯化钡质量为x,和氯化钡反应的碳酸钠质量为y,NaOH溶液质量增加4.4g,说明碳酸钠和稀盐酸反应生成二氧化碳质量是4.4g,烘干后得到固体的质量为19.7g,说明碳酸钠和氯化钡反应生成碳酸钡质量是19.7g,
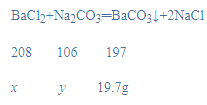
![]() x=20.8g,
x=20.8g,
![]() y=10.6g,
y=10.6g,
混合溶液中BaCl2的质量分数为:![]() ×100%=20.8%,
×100%=20.8%,
答:混合溶液中BaCl2的质量分数为20.8%;
(2)设与稀盐酸反应的碳酸钠质量为z,
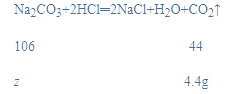
![]()
z=10.6g,
恰好完全反应时碳酸钠溶液质量为:![]() =200g,
=200g,
经过滤后所得滤液的质量为:100g+200g-19.7g-4.4g=275.9g,
答:经过滤后所得滤液的质量为275.9g。


科目:初中化学 来源: 题型:
【题目】小明参观某养鱼池时,好奇的发现农民向养鱼池中撒一种淡黄色固体——过氧化钙,用来增加鱼池中的含氧量。
小明刚学完氧气的实验室制法,于是他想可否用过氧化钙制取氧气。
(提出问题)过氧化钙可否用于制取氧气?
(查阅资料)部分内容如下:过氧化钙(CaO2)室温下稳定,在300℃时分解生成氧气,主要用途可做增氧剂、杀菌剂等。
(猜想与验证)
(1)小明依据资料显示:加热过氧化钙可制取氧气。
实验装置 | 实验主要过程 |
| ①检查装置气密性。操作如下:先将导管伸入液面下,用手紧握试管,观察到________,松开手后,导管口有液面上升。 |
实验结论:加热过氧化钙可制取氧气。
(2)小明联想到农民用过氧化钙增加鱼池中的含氧量,提出猜想Ⅱ.
猜想Ⅱ:过氧化钙与水反应可制取氧气。
实验装置 | 实验主要过程 |
| ①检查装置气密性。 |
实验结论:不能用过氧化钙与水反应制取氧气。
分析与反思:
虽然没有快速收集到大量氧气,但由此实验现象,小明推导出农民用过氧化钙做增氧剂的主要原因是 。
(3)小明希望对此实验进行改进,使该反应加快,你能帮他提出建议吗?
你的合理建议: 。
这些建议是否可行,还需进一步通过实验验证。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】元素周期表是学习和研究化学的重要工具,它的内容十分丰富。如表是依据元素周期表画出的1~18号元素的原子结构示意图。
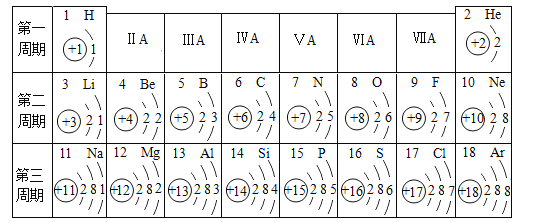
(1)原子序数为17的元素在化学反应中容易_____(填“得到”或“失去”)电子,形成_____(填离子符号)。
(2)原子序数为12的元素属于_____(填“金属”或“非金属”)元素,该元素与17号元素所形成的化合物的化学式为_____。
(3)原子序数为16的元素与表中原子序数为_____的元素具有相似的化学性质。
(4)表中不同种元素最本质的区别是_____(填字母)。
A.质子数不同 B.中子数不同 C.相对原子质量不同 D.电子数不同
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】盐城濒临黄海,海盐文化全国知名。某兴趣小组同学去盐场参观,带回了部分粗盐样品,并对其进行了如下探究:
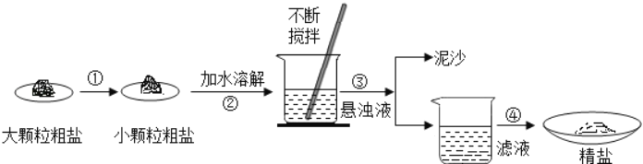
(1)操作①中必须用到的一种仪器是_____(填序号)
A.研钵 B.量筒 C.烧杯 D.试管
(2)操作③的名称是_____,操作④中用到玻璃棒,作用为_____。
(3)用提纯得到的“精盐”配制100g 6.5%的氯化钠溶液。经检测,溶质质量分数偏小,其原因可能有_____(填序号)。
①氯化钠固体不纯 ②称量时精盐与砝码放反了 ③量取水时俯视读数 ④装瓶时,有少量溶液洒出
(4)查阅资料得知:粗盐中除含少量泥沙等不溶性杂质外,还含有少量的可溶性杂质(假定可溶性杂质只有MgCl2一种),为了得到较纯净的氯化钠,小组同学将所得的“精盐”又作了如下处理:
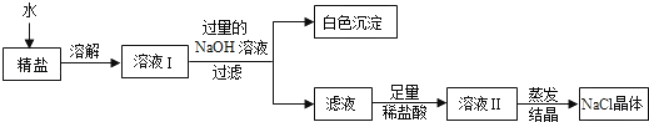
①白色沉淀的化学式为_____。
②在得到的滤液中加入足量的稀盐酸的目的是_____。
③若实验过程中不考虑损耗,最终得到的NaCl固体的质量将_____(填“大于”、“小于”或“等于”)原精盐中NaCl的质量。
(5)含量计算:称取10克该精盐经过上述1、2步操作后测得白色固体质量为0.29克,该精盐(不考虑其它杂质)中氯化钠的质量分数为_____(写出计算结果)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】我国化学家侯德榜创立的侯氏制碱法为纯碱工业技术的发展做出了杰出的贡献。
在制备纯碱的过程中涉及NaCl、NH4Cl、NaHCO3等物质。请结合表格数据回答下列问题:
温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | |
溶解度/g | NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.2 |
NaHCO3 | 6.9 | 8.2 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 | |
(1)表中物质中,溶解性属于可溶的物质是_____。
(2)在40℃时,向100g水中加入50gNH4Cl,充分搅拌所得溶液质量为_____g:保持烧杯中各物质质量不变,升温至50℃时,所得溶液溶质的质量分数是_____。
(3)要使20℃时接近饱和的 NaHCO3溶液变成该温度下的饱和溶液,可采用的一种方法是_____。
(4)有一杯60℃的NH4Cl的不饱和溶液(如图A,水为100g),经过如图的变化过程(在整个过程中水分的蒸发忽略不计),请判断:
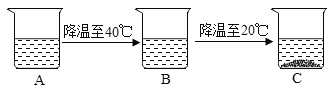
①有关三个烧杯中溶液的下列说法中,正确的是_____(填字母序号)。
a.在变化过程中,溶解度一定发生改变
b.B烧杯中的溶液一定是不饱和溶液
c.由40℃降温至30℃时溶液质量有可能减少
d.A到B的变化过程中,溶液中溶质的质量分数没有发生改变
②A烧杯中溶解的溶质的质量m的范围是_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】用图中操作可完成甲、乙两个实验.甲实验为粗盐中难溶性杂质的去除,乙实验为配制一定溶质质量分数的氯化钠溶液.下列说法中,正确的是( )

A. 甲实验的步骤是①④⑤,其中去除杂质的关键步骤是蒸发
B. 甲实验各步操作中的玻璃棒都是用来搅拌的
C. 乙实验按照②③①的步骤进行操作,会导致配制的溶液浓度偏小
D. 乙实验中,若①所用烧杯刚刚用清水洗过,会导致配制的溶液浓度偏大
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】化学反应之间、化学物质之间、微粒之间具有包含、并列、交叉等关系。下表中X、Y符合如图所示关系的是( )
A | B | C | D | |
X | 单质 | 化合反应 | 纯净物 | 化合反应 |
Y | 化合物 | 分解反应 | 混合物 | 氧化反应 |
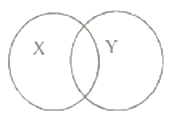
A. AB. BC. CD. D
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】甲、乙,丙三种物质之间有如图所示转化关系其中乙为黑色金属单质,甲为黑色氧化物,丙溶液呈浅绿色。
![]()
(1)乙转化为甲的过程中_____(填“放出”或“吸收”)热量。甲转化为乙的化学方程式为_____。
(2)乙转化为丙所用试剂可以是_____溶液。
查看答案和解析>>
科目:初中化学 来源: 题型:
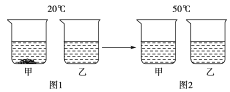
【题目】控制变量法是科学探究中常用的方法之一。
(1)在探究固体物质的溶解度时,需要考虑的因素有:①溶质的种类; ②溶剂的种类;③溶质最多被溶解的质量; ④溶剂的质量; ⑤温度。
如测定“某物质在不同温度下的溶解度”,研究的是_________ (填序号)受温度的影响,这就需要控制其他因素保持不变。
(2)右表是利用控制变量法测得的氯化钠、硝酸钾在不同温度时的溶解度,请根据表格内容及实验现象回答下列问题。
温度(℃) | 20 | 40 | 50 | |
溶解度/g | NaCl | 36.0 | 36.6 | 37.0 |
KNO3 | 31.6 | 63.9 | 85.5 | |
①从上表可知,两种物质的溶解度受温度变化影响较大的是____________;
②20℃时,将等质量的NaCl、KNO3分别放入盛有100 g水的两个烧杯中,充分溶解后如图1所示,升温到50℃时如图2所示。试判断:50℃时甲烧杯中的溶液一定是______(填“饱和溶液”、“不饱和溶液”或“不能确定”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com