
| BaCl2溶液 |
| 加足量稀硫酸 |
| 加足量稀硫酸 |
| BaCl2溶液 |


 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案科目:初中化学 来源: 题型:
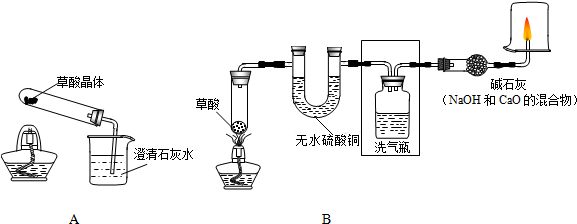
查看答案和解析>>
科目:初中化学 来源: 题型:
| 实验步骤 | 实验现象与结论 |
| ①取少量白色固体于试管中,加水振荡至全部溶解 | 无色溶液 |
| ②用pH试纸测①溶液的pH值 | 溶液的pH>7,说明氢氧化钠固体没有变质 |
| 实验步骤 | 实验现象与结论 |
| ①取少量白色固体于试管中,加水进行振荡至全部溶解 | 无色溶液 |
| ②向①溶液中加入适量氯化钡溶液 | 现象A,说明氢氧化钠固体已变质 |
查看答案和解析>>
科目:初中化学 来源: 题型:
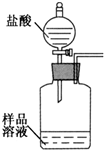 (2009?石景山区二模)烧碱中常含有碳酸钠.为了测定某烧碱样品中烧碱的质量分数,甲、乙两同学分别设计了如下的实验方案.
(2009?石景山区二模)烧碱中常含有碳酸钠.为了测定某烧碱样品中烧碱的质量分数,甲、乙两同学分别设计了如下的实验方案.| 实验步骤 | 解释与结论 |
| 准确称量10.6g的烧碱样品,在烧杯中加足量蒸馏水溶解 | 氢氧化钠溶解时有 放热 放热 现象 |
| 加入过量的氢氧化钙溶液,至反应完全 | 反应的化学方程式为 Ca(OH)2+Na2CO3═CaCO3↓+2NaOH Ca(OH)2+Na2CO3═CaCO3↓+2NaOH |
| 过滤,称量干燥后的滤渣质量为1g | 滤液中的溶质为 Ca(OH)2、NaOH Ca(OH)2、NaOH |
| 计算 | 烧碱样品中烧碱的质量分数为 90% 90% |
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com