
����Ŀ����ͼ��A.B�������ʵ��ܽ�����ߣ�����ͼʾ�ش��������⣺
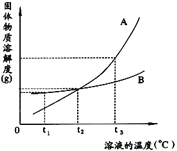
(1)t1��ʱ������ֻʢ��100gˮ���ձ��У��ֱ����A.B���������������ܽ�Ϊֹ��������Һ���������������ϴ����___________��Һ(����A������B��)��
(2)t2��ʱ�������Ƶ�������A.B�������ʵı�����Һ������ˮ��������ϵ��A___________B�� (��д��������������������������ͬ)
(3)��t2���A.B�������ʵı�����Һ��200g��������t1�棬���������������ϵ��A_______B��
(4)��t2���A��B�������ʵı�����Һ��200g��������t3�棬��ʹ������Ϊ������Һ�������ı��ܼ��������������������ʵ�������ϵ��A_______B��
���𰸡� B = > >
�������������ܽ�����߷��������(1)���ܽ�����߿�֪��t1��ʱB���ʵ��ܽ�ȴ���A���ʵ��ܽ�ȡ�������ֻʢ��100gˮ���ձ��У��ֱ����A.B���������������ܽ�Ϊֹ��������Һ���������������ϴ����B��(2)t2��ʱ��A���ʵ��ܽ�ȵ���B���ʵ��ܽ�ȡ������Ƶ�������A��B�������ʵı�����Һ������ˮ��������ϵ��A=B��(3)���ܽ�����߿�֪��A���ʵ��ܽ�����¶ȵ�Ӱ��ϴ�B���ʵ��ܽ�����¶ȵ�Ӱ���С����t2����A.B�������ʵı�����Һ��200g��������t1�������������������ϵ��A>B��(4) ���ܽ�����߿�֪��A���ʵ��ܽ�����¶ȵ�Ӱ��ϴ�B���ʵ��ܽ�����¶ȵ�Ӱ���С��t3��ʱ��A���ʵ��ܽ�ȴ���B���ʵ��ܽ�ȡ���t2����A��B�������ʵı�����Һ��200g��������t3������ʹ������Ϊ������Һ�������ı��ܼ��������������������ʵ�������ϵ��A >B��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ���Ȼ��ơ��Ȼ�狀�̼�������������ʵ��ܽ�����ߣ�����˵����ȷ����
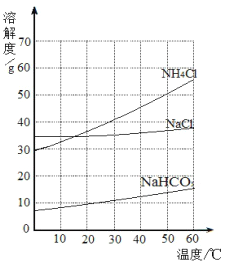
����20��ʱ���������ʵ���Һ������������ΪNH4Cl>NaCI>NaHCO3
����20��ʱ���Ȼ��ƺ��Ȼ�粒����20g�ֱ�����50gˮ��������Һ���DZ�����Һ
�۵��������������ʵı�����Һ��40�潵�µ�0�棬������Һ������������ΪNH4CI>NaCI>NaNCO3
�����ýᾧ�����Ȼ��ơ��Ȼ�炙�����з�����Ȼ�淋�����¶ȿ�����10������
A. �٢ڢ� B. �٢ۢ� C. �٢� D. �ڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʯ�ҡ��������̡�����ˮ��ϡ���ᡢ��������Һ������ͭ��Һ������������Һ�����������ʰ�Ҫ��д����ѧ����ʽ(���ʲ����ظ�ʹ��)
(1)�ֽⷴӦ__________________________________ ��
(2)���Ϸ�Ӧ__________________________________ ��
(3)�û���Ӧ___________________________________��
(4)�кͷ�Ӧ___________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ס������ֹ������ʵ��ܽ����������ͼ��ʾ������˵����ȷ����

A��20��ʱ������Һ�����ʵ���������һ��������Һ�Ĵ�
B����40��ʱ��һ����������Һ������20������Һ��������
C�����ܽ�ȴ����ҵ��ܽ��
D��40��ʱ���ֱ���100gˮ�и�����30g�ס��ң�ͬʱ������20�����ס�����Һ��Ϊ������Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ͻ��ǹ�ҵ��Ӧ����㷺��һ����ɫ�����ṹ���ϣ��ں��ա����졢��������е���졢 ��������ѧ��ҵ���Ѵ���Ӧ�á���ҵ���õķ��ٷ�չ�������Ͻ�������������࣬ʹ���Ͻ���о�Ҳ��֮���롣��֪ij���Ͻ��ĩ�����⣬����������ͭ�е�һ�ֻ����֡�ij��ȤС������ʦ��ָ���£������Ͻ��ĩ������ͭ�Ĵ������������̽����
���������ϡ���������������Һ��Ӧ����ʽΪ2Al+2NaOH+2H2O��2NaAlO2+3H2��( ����NaAlO2����ˮ)�� Fe��Cu��������������Һ��Ӧ��
����1���úϽ��ĩ�г����⣬����������
����2���úϽ��ĩ�г����⣬������ͭ��
����3���úϽ��ĩ�г����⣬����������ͭ��
��ʵ��̽��������ʵ�����ѡ����Լ���10%���ᡢ30%NaOH��Һ��
ʵ�鷽�� | ʵ������ | ���� |
��ȡһ�����ĺϽ��ĩ���ӹ�����___________����ַ�Ӧ����ˣ��������á� | ��ĩ�����ܽ⣬��������ų��� | �Ͻ���һ������________ �� |
��ȡ����������������ӹ�����___________����ַ�Ӧ�� | ���������ܽ⣬��������ų�����Һ��dz��ɫ�� | �Ͻ���һ������_________�� |
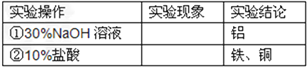
��̽�����ۡ����� _________������
����˼��һ����˵�����ý�������������ᷴӦ���������ᡢ��ܷ�Ӧ��˵����������������ʡ�д������ϡ���ᷴӦ�Ļ�ѧ����ʽ ___________________��
����չ�������
Ϊ����֤�������Ľ������ǿ����С��ͬѧ���������ʵ�鷽�����ѱ������ͬ����˿����ƬͬʱͶ�뵽��ͬ�����ϡ�����У��ȽϷ�Ӧ�ľ��ҳ̶ȡ��������۸÷����ڲ��������кͿ��Ʊ����ϵIJ���֮����
���������еIJ���֮��___________________��
���Ʊ����ϵIJ���֮��________________________��
���������һ�ֲ�ͬ���͵�ʵ�鷽������֤�������Ľ������ǿ����________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л�ѧ�У�����ѧϰ����ͼ���кͷ�Ӧ��ʵ����H++OH��=H2O��������ʵ�ʲμӷ�Ӧ�����ӷ�������ʾ��Ӧ��ʽ�ӽ����ӷ���ʽ�����ӷ���ʽ����дһ�㰴���²��裺(��Na2SO4��BaCl2��ӦΪ��)��д��Na2SO4��BaCl2��Ӧ�Ļ�ѧ����ʽ��___________�� �ڰ�������ˮ������д��������ʽ�������ܵ����ʡ������ˮ�����û�ѧʽ��ʾ����������ʽ�ɸ�д�ɣ�2Na��+SO42-+Ba++2Cl-=BaSO4��+2Na��+2Cl- ��ɾȥ����ʽ���߲��μӷ�Ӧ�����ӣ�Ba2++SO4-�TBaSO4���� �ܼ�鷽��ʽ���߸�Ԫ�ص�ԭ�Ӹ����͵�������Ƿ���ȡ�
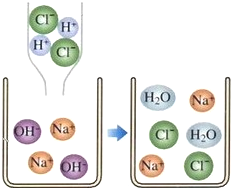
��ش�
(1)���и����е����ӣ�������Һ�д����������________
A��Na+��Mg2+��Cl����SO4 �� B��Na+��H+��Cl����OH��
C��Na+��Cu+��Cl����SO42�� D��Na+��NH4+��Cl����OH��
(2)д��ϡ�������ʯ��ʯ����������Ӧ�����ӷ���ʽ_________.
(3)д��һ�������ӷ���ʽMg+2H+=Mg2++H2�����Ӧ�Ļ�ѧ����ʽ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ѧϰ��ѧ�벻��ʵ��
��1����ʵ����ϣ���ʦҪͬѧ������15�����Ȼ�����Һ50 g��
�ټ��㣺����15�����Ȼ�����Һ50 g�����Ȼ��Ƶ�����Ϊ_____________g��
�ڼ�ͬѧ����ͼ��ʾ�������β�����
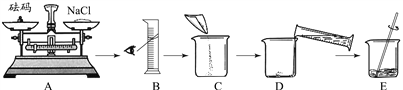
�����IJ���������_______������ĸ��ţ���E�в�������������_________________��
����ͬѧ�ڽ������õ��Ȼ��Ƶ����ձ�ʱ����һ�����Ȼ��ƹ�����������������Һ��������������15%���___________���ƫ�͡�����ƫ�ߡ�������ȡ���
��2���������ͼװ�ã��ش�������⣺
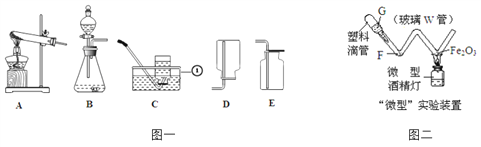
��д��ͼһ�б�Ţٵ��������ƣ�____________��
��ʵ�����ù���������Һ��ȡO2����ѡ�õķ���װ��Ϊ______����дͼһ��װ����ţ���
��С��������Aװ��ͨ�����ȸ���������������˷���װ���л�ȱ�ٵ�һ��ʵ����Ʒ��______________�����ȸ�������������ķ�Ӧ����ʽΪ��_____________________��
��ͼ��Ϊij�֡��͡�ʵ��װ�á����G��װϡ���ᣬF��������п��������������ԭ��������ʵ�飻д���á��͡�װ�ý��и�ʵ����е�һ���ŵ㣺_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������е�ʵ�鳣�������ش��й����⡣
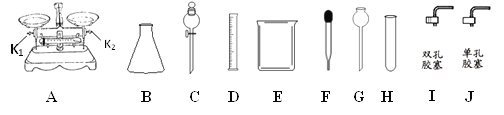
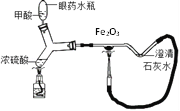
(1)����B��������__________������G��������___________��
(2)����һƿ������������Ϊ35%��Ũ���ᣬ����ϡ������100g������������Ϊ10%��ϡ���ᣬ����ʹ������A���������ϣ�����֪��Ũ�����й�________�����ݣ��Ӷ������������������е�D��E��������������_______(�����)������Һ��ʵ������ȡCO2��װ��һ�����ܹ����Ʒ�Ӧ���ʵķ���װ�ã�Ӧѡ�����������е�__________���䷴Ӧ����ʽΪ____________________________��
(3)������A����5g��NaCl���壬��Ҫ����A���е�ƽ��������㣬�����˵����̷ֱ�ŵ�������________���������˵�ƽ����ĸ������ƽ�������б��Ӧ�ý�K2��_________(ѡ��������������������ͬ)���ڡ�
(4)ij��ʵ��װ����ͼ���������ȵ�Ũ���ᷴӦ����CO ������CO��ԭ������,��Ӧ����������������ɫ�仯Ϊ______�� ����ʯ��ˮ����������___________����װ��Ϊ��ʵ��װ�ã���ʵ����ŵ���__________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�Ǽס��ҡ������ֹ������ʣ��������ᾧˮ�����ܽ�����ߣ�����˵����ȷ����
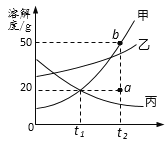
A. t1��ʱ�ס���������Һ��������������һ�����
B. ��t2��ʱ�ס��ҡ����������ʵı�����Һ�ֱ�����t1�棬������Һ������������������>��>��
C. t2��ʱ�ס��ҡ����ı�����Һ�ֱ��������������ˮ���������ʵ��������ף��ң���
D. ��ʹ��a�ļ���Һ60g��ת������b������Ӧ����30g����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com