
 某固体物可能由Na2SO4、NaCl、Na2CO3、KNO3中的一种或几种组成,现进行如下实验.
某固体物可能由Na2SO4、NaCl、Na2CO3、KNO3中的一种或几种组成,现进行如下实验.分析 根据硫酸钠和氯化钡会生成不溶于酸的白色沉淀硫酸钡,碳酸钠和氯化钡会生成溶于酸的碳酸钡沉淀,结合框图白色沉淀可以溶于硝酸生成气体的性质即可判定它是碳酸钡,以此为突破口,结合物质的性质及反应的现象逐一分析,即可正确解答.
解答 解:(1)Na2SO4和Na2CO3都可与BaCl2发生反应,分别生成硫酸钡和碳酸钡沉淀,但硫酸钡不溶于硝酸,所以可判断白色沉淀A为碳酸钡,化学式为BaCO3;碳酸钡与硝酸反应生成硝酸钡、水和二氧化碳,所以无色气体D为二氧化碳;故答案为:BaCO3;
(2)由(1)①通过推导可知,原固体中一定含有碳酸钠,碳酸钠与氯化钡反应生成碳酸钡沉淀和氯化钠,由图示可知“B中的酸根离子只有一种”,所以原固体中可能含有氯化钠,一定不含有 Na2SO4、KNO3;故答案为:Na2SO4、KNO3;
(3)可能含有的物质是氯化钠,检验氯离子常用硝酸银和稀硝酸,但要排除碳酸钠的干扰,因此加入足量的硝酸钡可以除去碳酸钠;故答案为:除去Na2CO3.
点评 本题为框图式推断题,在解此类题时,首先分析题中所给物质的性质,然后依据题中的现象确定各种物质的存在性,最后确定混合物的成分.


科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题

| 实验现象 | 结论与化学方程式 |
| A中出现黑色固体;B中澄清石灰水变浑浊;D中溶液逐渐变为墨绿色;F中烧杯内壁出现无色液滴. | B中发生反应的化学方程式为CO2+Ca(OH)2═CaCO3↓+H2O;装置E中药品的作用是除去气体中混有的水蒸气;收集的气体样品中一定含有H2S、CO2、CH4、O2. |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验操作 | 实验现象 | 实验结论 |
| 取样于试管中,加水溶解,往上层溶液中滴加无色酚酞 | 溶液显红色 | 变质的熟石灰中仍含氢氧化钙 |
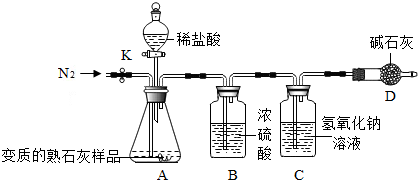
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 熟石灰可用来做建筑材料以及中和酸性土壤 | |
| B. | 用水灭火的原理是降低了可燃物的着火点 | |
| C. | 用C、H2、CO都可以将CuO还原成Cu | |
| D. | 燃烧和缓慢氧化都是放热反应 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
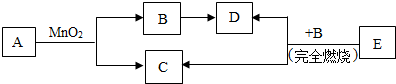
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
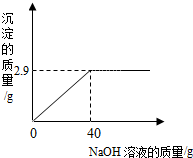 某同学测定一瓶标签残缺的硫酸镁溶液的溶质质量分数,取30g该溶液,向其中逐滴加入溶质质量分数为10%的氢氧化钠溶液.生成沉淀的质量与所用氢氧化钠溶液的质量关系如图所示.反应方程式为:MgSO4+2NaOH=Na2SO4+Mg(OH)2↓
某同学测定一瓶标签残缺的硫酸镁溶液的溶质质量分数,取30g该溶液,向其中逐滴加入溶质质量分数为10%的氢氧化钠溶液.生成沉淀的质量与所用氢氧化钠溶液的质量关系如图所示.反应方程式为:MgSO4+2NaOH=Na2SO4+Mg(OH)2↓查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com