
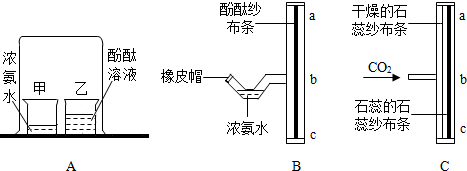
分析 【回忆课本】
氨气能和水反应生成氨水,氨水显碱性,能使酚酞试液变红色;
根据实验现象可以判断微观粒子运动的快慢;
【实验改进】
胶头滴管可以用来取用少量液体;
氨气的密度比空气小;
温度越高,微观粒子运动的越快;
【实验反思】
实验装置不同,优缺点不同;
【实验拓展】
二氧化碳的密度比空气大,能和水反应生成碳酸,碳酸显酸性,能使石蕊试液变红色.
解答 解:【回忆课本】
(1)浓氨水中的氨气容易挥发出来,挥发出的氨气分子运动到乙烧杯中,和水反应生成氨水,从而使酚酞试液变红色,因此实验中观察到的现象是:乙烧杯中酚酞试液变红.
故填:乙烧杯中酚酞试液变红.
(2)该实验不仅说明微粒的运动性,还说明氨分子运动的速率比酚酞分子的运动速率快.
故填:快.
【实验改进】
(2)用胶头滴管吸取少许浓氨水,将其滴入T形三通管的细弯管处,然后用橡皮帽封闭管口.
故填:胶头滴管.
(3)一会儿,浓氨水中挥发出的氨气分子不断上升,与ab段的湿润的酚酞纱布条接触,氨气和水反应生成氨水,从而使ab段纱布条变成红色.
故填:ab.
【实验结论】
改进实验说明,氨气密度比空气小;
氨分子在空气中主要向上运动,且温度升高其运动速率加快.
故填:小;上;加快.
【实验反思】
改进实验与课本实验相比较,有不少的优点,例如可以节省药品,操作更简单,几乎没有污染等.
故填:节省药品.
【实验拓展】
在通入二氧化碳气体后,由于二氧化碳的密度比空气大,二氧化碳气体主要向下运动,与bc段纱布条接触时,二氧化碳和水反应生成碳酸,反应的化学方程式为:CO2+H2O=H2CO3,碳酸显酸性,能使bc段纱布条变红.
故填:bc段纱布条变红;CO2+H2O=H2CO3.
点评 实验现象是物质之间相互作用的外在表现,因此要学会设计实验、观察实验、分析实验,为揭示物质之间相互作用的实质奠定基础.


 53随堂测系列答案
53随堂测系列答案科目:初中化学 来源: 题型:解答题

| 25℃时,氢氧化钠沉淀的pH范围 | |||
| Fe(OH)3 | Al(OH)3 | Mg(OH)2 | |
| 开始沉淀的pH | 1.5 | 3.3 | 10.4 |
| 沉淀完全的pH | 3.2 | 5.2 | 12.4 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | K2MnO4、MnO2 | B. | KMnO4、MnO2 | ||
| C. | KMnO4、K2MnO4、MnO2 | D. | KMnO4、K2MnO4 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
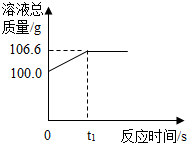 为测定某赤铁矿石中氧化铁的质量分数,小龙和他的同学用足量的一氧化碳与10g赤铁矿石样品充分反应(杂质不参与反应),并将生成的气体用一定量的氢氧化钠溶液完全吸收,该溶液总质量与反应时间的变化关系如图.
为测定某赤铁矿石中氧化铁的质量分数,小龙和他的同学用足量的一氧化碳与10g赤铁矿石样品充分反应(杂质不参与反应),并将生成的气体用一定量的氢氧化钠溶液完全吸收,该溶液总质量与反应时间的变化关系如图.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
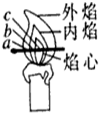 小李对蜡烛(主要成分是石蜡)及其燃烧进行了如下探究.请填写下列空格:
小李对蜡烛(主要成分是石蜡)及其燃烧进行了如下探究.请填写下列空格:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com