
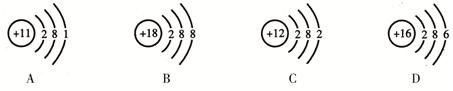
研究表明,原子的最外层电子数相同的元素,具有相似的化学性质。请根据下列原子的结构示意图找出具有相似化学性质的一组 ( )
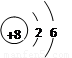
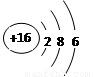

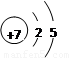
① ② ③ ④
A、①② B、②④ C、①③ D、②④
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:

查看答案和解析>>
科目:初中化学 来源: 题型:
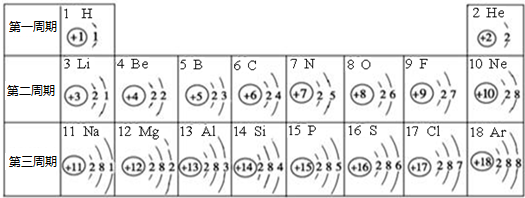
| 第一周期 | 1H |
2He | ||||||
| 第二周期 | 3Li |
4Be |
5B |
6C |
7N |
8O |
9F |
10Ne |
| 第三周期 | 11Na |
12Mg |
13Al |
14Si |
15P |
16S |
17Cl |
18Ar |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解



查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com