
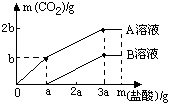
有两份60 g 10%的NaOH溶液,向其中分别通入质量不等的CO2,得溶液A、B,然后向A、B溶液中分别逐渐加入等质量等浓度的稀盐酸,放出CO2的情况如图所示.求A、B溶液中分别含什么溶质,其质量分别是多少?
|
NaOH溶液中通入CO2,根据通入CO2的量不同,所得溶液中的溶质可能有以下几种情况. 2NaOH+CO2=Na2CO3+H2O 80 44 NaOH+CO2=NaHCO3 40 44 ①m(CO2)< ②m(CO2)= ③ ④m(CO2)≥ 分析图,根据图中提供的溶液中加盐酸生成CO2的情况,可能发生以下三个反应 Na2CO3+2HCl=2NaCl+H2O+CO2↑ (1) NaHCO3+HCl=NaCl+H2O+CO2↑ (2) NaOH+HCl=NaCl+H2O (3) 反应顺序为盐酸先和NaHCO3反应,再和Na2CO3反应;或盐酸先和NaOH反应,再和Na2CO3反应. 依照具体图示,可以推断出∶ B溶液中先加入一定量盐酸时,无气体放出,则溶液中肯定含NaOH,后来继续加盐酸时,放出CO2,则溶液中还含有Na2CO3为情况①. A溶液中先加入a g盐酸,放出CO2 b g,继续加入2a g盐酸,放出CO2 b g结合化学方程式(1)(2),可知溶液中含Na2CO3、NaHCO3,为情况③.且根据生成的CO2质量相同,可求得 m(Na2CO3)∶m(NaHCO3)=106∶84=53∶42 设m(Na2CO3)=m m(NaHCO3)= 根据Na元素守恒 m× m=2.65 g m(NaHCO3)= B溶液中消耗2a g的盐酸,生成b g CO2,与A溶液中后半段情况相同,所以B溶液中 m(Na2CO3)=2.65 g 设2.65 g Na2CO3消耗HCl质量为X, Na2CO3+2HCl=2NaCl+H2O+CO2↑ 106 73 2.65 g x 解得x= 根据图知,与NaOH反应消耗HCl的质量为 设NaOH的质量为y, NaOH+HCl=NaCl+H2O 40 36.5 y y=1 g A溶液中含Na2CO3 2.65 g,NaHCO3 2.1 g B溶液中含NaOHl g,Na2CO3 2.65 g |


湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com