
| 物质 | 甲 | 乙 | 丙 | 丁 |
| 反应前质量(g) | 20 | 5 | 12 | 40 |
| 反应后质量(g) | 待测 | 5 | 6 | 24 |
| A. | 物质丁一定不是单质 | |
| B. | 甲、丙两种物质在反应中的质量比为3:1 | |
| C. | 该反应一定不是氧化反应 | |
| D. | 反应后容器中甲的质量是42g |
分析 在一密闭容器中,有甲、乙、丙、丁四种物质,在一定的条件下反应一段时间后,测得反应前后各物质质量如表可知,根据质量守恒定律,则可求甲的待测值;则由物质的增加或减少,可推测反应物与生成物等信息.
解答 解:根据质量守恒定律,由表格中的数字可知:20+5+12+40=待测+5+6+24,故待测=42克,则可推测反应物为丙、丁;生成物为甲;乙的质量反应前后不变,可能为催化剂.
A、该反应为:丙+丁→甲,物质丁不一定是单质,错误;
B、甲、丙两种物质在反应中的质量比为:(42-20):(12-6)=11:3,错误;
C、不知反应物中是否有氧气,故不知是否是氧化反应,错误;
D、反应后容器中甲的质量是42g,正确.
故选D.
点评 掌握质量守恒定律的内容及其应用;了解催化剂的“一变二不变”的特点与催化作用;掌握单质与化合物的判别方法.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:初中化学 来源: 题型:计算题
 碘元素对青少年智力发育影响很大,我国从1994年开始强制食盐加碘量,即在食盐中加入碘酸钾(KIO3),以防止碘缺乏病的发生.由原来每千克食
碘元素对青少年智力发育影响很大,我国从1994年开始强制食盐加碘量,即在食盐中加入碘酸钾(KIO3),以防止碘缺乏病的发生.由原来每千克食查看答案和解析>>
科目:初中化学 来源: 题型:解答题
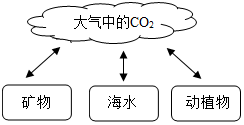 如图是自然界碳循环的示意图,请据图分析后回答:
如图是自然界碳循环的示意图,请据图分析后回答:查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 微粒观:原子都由质子,中子和核外电子三种微粒构成 | |
| B. | 分类观:干冰和冰都属于氧化物 | |
| C. | 能量观:天然气做燃料是将化学能转变成热能 | |
| D. | 守恒观:在电解水反应前后,氢原子和氧原子种类和数目均不变 |
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com