
Na2SO3中S元素的化合价为( )
A. +6 B. +4 C. +2 D. -2
B 【解析】钠元素显+1价,氧元素显-2价,设硫元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:(+1)×2+x+(-2)×3=0,则x=+4价。故选B。 备战中考寒假系列答案
备战中考寒假系列答案科目:初中化学 来源:四川省2018届九年级下学期第二次模拟考试化学试卷 题型:填空题
侯德榜是我国著名的化学家,为纯碱和氮肥工业技术的发展作出了杰出的贡献,他发明的侯氏制碱法大大提高了原料的利用率,其工业流程大致如图:

(1)上述流程中,用到的原料有空气、焦炭、水、二氧化碳、_________等.
(2)上述流程中,已知步骤②发生的是化合反应,步骤⑤发生的是分解反应,则步骤②、⑤发生反应的化学方程式是:②_________,⑤_________.
(3)上述流程中,可循环利用的物质是_________.
(4)上述流程中,“一种氮肥”的化学式是_________.
(1)氯化钠饱和溶液;(2)N2+3H22NH3;2NaHCO3Na2CO3+H2O+CO2↑; (3)二氧化碳、水;(4)NH4Cl。 【解析】 试题分析:(1)由侯氏制碱法的工业流程图,用到的原料有空气、焦炭、水、二氧化碳、氯化钠饱和溶液等;(2)已知步骤②发生的是化合反应,即氮气和氢气在高温、高压、催化剂的作用下生成氨气;步骤⑤发生的是分解反应,即碳酸氢钠固体加热生成碳酸钠...查看答案和解析>>
科目:初中化学 来源:黑龙江省大庆市杜尔伯特县2018届九年级(五四学制)下学期期中考试化学试卷 题型:单选题
元素X的原子的第三电子层有2个电子,其相对原子质量为24,元素Y的原子的第二电子层有6个电子,其相对原子质量为16。则X和Y所形成的化合物的相对分子质量量是
A. 40 B. 60 C. 70 D. 80
A 【解析】根据X元素原子的第三层有2个电子,可判断易失去最外层2个电子表现出+2价,根据核外电子排布特点,也可知X原子有12个电子,故可知X为镁原子;根据Y元素原子的第二层有6个电子,可判断其核外有8个电子,即核内有8个质子,故Y为氧原子,其第二层有6个电子易得2个电子表现出-2价;所以,它们形成化合物的化学式为MgO;其相对分子质量为:24+16=40,故选A。查看答案和解析>>
科目:初中化学 来源:四川省内江市2018届九年级下学期第二次模拟考试化学试卷 题型:科学探究题
小明做“将浓硫酸滴到一小块布上”的实验,发现生成的炭上冒“白烟”,推测炭能与浓硫酸反应。欲探究其生成物成分,通过简单分析及实验确定无H2和O2,因此继续进行如下探究。
【查阅资料】①SO3能被浓硫酸及水吸收;
②SO2性质:能使品红褪色,能被高锰酸钾溶液吸收,能使澄清石灰水变浑浊;
③CO可与PdCl2溶液反应:PdCl2+CO+H2O===Pd(黑)↓+2HCl+CO2;不与KMnO4溶液反应。
【提出猜想】生成物的成分可能为;
Ⅰ.H2O、CO、SO2;Ⅱ.H2O、CO2、SO2;Ⅲ.H2O、CO、CO2、SO2。
【实验验证】小明设计了如下实验:
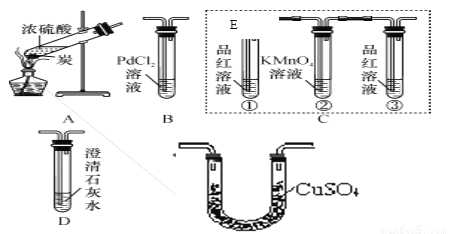
【分析讨论】
①根据实验目的,按气流从左到右的方向将实验仪器组装完整:A→_____→______→D →___。
②置E中所加药品是_________。
③置C中②的作用是除去SO2气体,则③试管中品红溶液的作用是_______________________。
④D中澄清石灰水变浑浊,方程式为_____________________________________________。
【实验结论】实验观察到的部分现象是:B中未见黑色沉淀,则猜想_____正确,
写出炭与浓硫酸在加热条件下反应的化学方程式_____________________。
E C B 无水硫酸铜 检验二氧化硫是否被除尽 Ca(OH)2+CO2═CaCO3↓+H2O Ⅱ C+2H2SO4(浓) CO2↑+2SO2↑+2H2O 【解析】【解答】【分析讨论】①根据题中所给物质的性质氯化钯能与一氧化碳反应故装置B用来验证生成物是有无一氧化碳气体;根据品红能与二氧化硫反应,且高锰酸钾溶液能吸收二氧化硫气体故装置C用来验证二氧化硫气体并吸收二氧化硫气体;根据三个猜想中都有...查看答案和解析>>
科目:初中化学 来源:四川省内江市2018届九年级下学期第二次模拟考试化学试卷 题型:单选题
下列图像能正确反映其对应关系的是 ( )

A. ①表示电解水生成氢气和氧气的质量与反应时间的关系
B. ②高温煅烧一定量石灰石制生石灰,剩余固体中钙元素的质量分数与反应时间的关系
C. ③向氢氧化钠溶液中不断加水,溶液 pH 与加入水的质量关系
D. ④相同质量的 Mg、Fe 分别与足量的稀盐酸反应,产生氢气的质量与反应时间的关系
D 【解析】A、电解水生成氢气和氧气的质量比是1:8,不是2:1,故A错误;B、石灰石在高温的条件下分解生成二氧化碳和氧化钙,钙元素的质量不变,但是随着石灰石的分解固体质量减少,所以石灰石受热分解时钙元素在固体中的质量分数增大直至石灰石完全分解,故B错误;C、碱溶液加水稀释时溶液pH不能等于7,更不会小于7,故C错误;D、相同的质量的镁和铁与足量的酸反应后,镁产生的氢气多,因为镁比铁活泼,所...查看答案和解析>>
科目:初中化学 来源:四川省内江市2018届九年级下学期第二次模拟考试化学试卷 题型:单选题
归纳总结是学习化学的基本方法。下面是某同学整理的部分化学知识,你认为都正确的选项是( )
A.物质的性质决定用途 | B.物质的鉴别 |
①浓硫酸具有吸水性——常用于干燥气体 ②CO具有可燃性——常用于炼铁 | ①可用石蕊试液鉴别CO和CO2 ②可用肥皂水区分硬水和软水 |
C.物质的构成 | D.化学符号的意义 |
①分子、原子、离子都可以直接构成物质 ②构成原子的微粒都不带电荷 | ①O2:两个氧原子 ②O2—:一个氧离子带两个单位负电荷 |
查看答案和解析>>
科目:初中化学 来源:山东省淄博市沂源县2018届九年级第一次模拟考试化学试卷 题型:填空题
多彩的“碳”,多姿的生活,让我们一起走进“碳”的世界。
(1)活性炭能净水,是利用了活性炭的_______性。
(2)金刚石经过琢磨后称为钻石,是由碳元素组成的一种单质。一句广告词“钻石恒久远,一颗永流传”被美国《广告时代》评为20世纪的经典广告之一,该广告词能体现钻石的________。
A.硬度大 B.不能导电 C.化学性质稳定 D.熔点低
(3)目前,人类以化石燃料为主要能源。化石燃料有煤、石油和_______,它们都属于_______(填“可再生”或“不可再生”)能源。
(4)以下表数据分析,等质量的天然气和碳完全燃烧,与煤炭相比,用天然气作燃料的优点有:______________(写一项)。
1g物质完全燃烧 | ||
产生二氧化碳的质量/g | 放出的热量/KJ | |
甲烷 | 2.75 | 56 |
碳 | 3.67 | 32 |
查看答案和解析>>
科目:初中化学 来源:四川省绵竹市2018届九年级第二次诊断考试化学试卷 题型:计算题
为了测定某生理盐水的溶质质量分数,实验过程和有关实验数据如下图所示:计算:该生理盐水的溶质质量分数是______________?
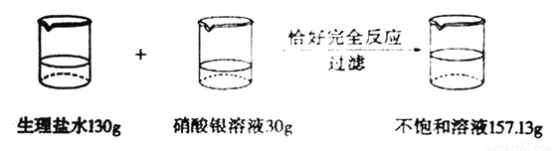
查看答案和解析>>
科目:初中化学 来源:四川省2018届九年级下学期三诊考试化学试卷 题型:填空题
我国著名化学家侯德榜先生发明了“侯氏制碱法”,其原理中重要的一步是向饱和食盐水中先后通入足量NH3和CO2制备NaHCO3,化学方程式:NaCl+ NH3+CO2+H2O= NaHCO3↓+NH4Cl某兴趣小组在实验室模拟该过程,请结合具体的步骤回答下列问题:

Ⅰ.气体制备
(1)二氧化碳气体制备
实验室常采用石灰石与稀盐酸反应制备CO2,其化学方程式为_____________。应选择的气体收集装置为______(选填装置对应的字母)。
(2)氨气制备: 实验室常用硫酸吸收氨气,防止污染空气,实验室制备NH3的反应原理为:Ca(OH)2(固)+2NH4Cl(固)  CaCl2+2H2O+2NH3↑。现要制备并干燥NH3,所选装置的正确连接顺序为_____→______(选择装置对应的字母)。实验室制备O2也可用上述制备NH3的发生装置,写出用该发生装置制备O2的化学方程式__________。
CaCl2+2H2O+2NH3↑。现要制备并干燥NH3,所选装置的正确连接顺序为_____→______(选择装置对应的字母)。实验室制备O2也可用上述制备NH3的发生装置,写出用该发生装置制备O2的化学方程式__________。
II. NaHCO3制备:
物质 | NaHCO3 | NH4Cl |
溶解度/g(20℃) | 9.6 | 37.2 |
(3)根据表格中的溶解度数据,解释20℃产物中NaHCO3能够先从溶液中结晶析出的原因________。
(4)该过程中另一产物NH4Cl在农业生产中常被用作______________。
CaCO3 + 2 HCl == CaCl2 + CO2 ↑+ H2O C B F 2KClO3 === 2KCl + 3O2↑ 20℃NaHCO3的溶解度小,先到达饱和后析出晶体 氮肥 【解析】(1)实验室用石灰石或大理石和稀盐酸反应制取二氧化碳的同时还生成了氯化钙和水,反应的化学方程式表示为CaCO3+2HCl=CaCl2+H2O+CO2↑;二氧化碳的密度比空气大,易溶于水,故只能用向上...查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com