
分析 根据反应的化学方程式可以判断欲制取相同质量Cu(NO3)2,消耗的硝酸质量由多到少的顺序;
氢氧化钠和二氧化硫反应生成亚硫酸钠和水;
根据反应的化学方程式和提供的数据可以进行相关方面的计算.
解答 解:(1)当制取硝酸铜的量是3Cu(NO3)2时,①消耗12HNO3,②消耗8HNO3,③消耗6HNO3.
故填:①>②>③.
(2)二氧化硫属于酸性气体,和氢氧化钠负硬度化学方程式为:2NaOH+SO2=Na2SO3+H2O.
故填:2NaOH+SO2=Na2SO3+H2O.
(3)解:设消耗铜的质量为x,
由Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O和CuSO4+Ba(NO3)2═Cu(NO3)2+BaSO4↓可知,Cu~BaSO4↓,
Cu~BaSO4↓,
64 233
x 11.65g
$\frac{64}{x}$=$\frac{233}{11.65g}$,
x=3.2g,
答:若在方案④中最后得到硫酸钡沉淀11.65克,则消耗的铜的质量为3.2g.
点评 计算消耗铜的质量时,可以根据铜和硫酸钡的质量关系进行计算,这样比较简单,要注意掌握这种方法.


科目:初中化学 来源: 题型:选择题
| A. | 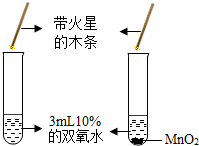 二氧化锰可以增加产生氧气的总量 | |
| B. | 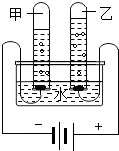 水由氢元素和氧元素组成 | |
| C. | 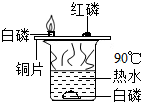 燃烧需要与氧气接触、且温度达到着火点 | |
| D. | 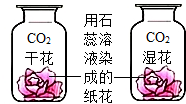 二氧化碳能使石蕊变红 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验步骤 | 设计目的 |
| 将氢氧化镁加入到热水中搅拌,滴入酚酞试液,并在上方滴一些植物油 | 证明隔绝空气证明红色消失与氧气和二氧化碳无关. |
| 实验方法及可能观察到的现象 | 结论 | |
| 取A、B两支试管,都加入等质量的Mg(OH)2和等质量的热水,振荡,各滴入数滴无色酚酞. | 对A试管的操作及可观察到的现象温度保持不变;红色没褪去; | 红色消失与氢氧化镁的溶解度随温度降低而减小有关 |
| 对B试管的操作及可观察到的现象自然冷却;红色褪去. | ||
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
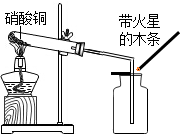 硝酸铜为蓝色固体,溶于水可得蓝色溶液.某实验小组同学用如图装置加热硝酸铜,发现固体由蓝色逐渐变黑,同时产生红棕色有刺激性气味的气体,带火星的木条复燃.
硝酸铜为蓝色固体,溶于水可得蓝色溶液.某实验小组同学用如图装置加热硝酸铜,发现固体由蓝色逐渐变黑,同时产生红棕色有刺激性气味的气体,带火星的木条复燃.| 实验操作 | 实验现象 | 实验结论 |
| 步骤I:将反应后试管中的固体加水充分溶解,过滤,洗涤,向滤渣中加入足量稀硫酸,加热 | 固体全部溶解,得到蓝色溶液 | 硝酸铜分解生成了氧化铜. |
步骤II:在如图的试管和集气瓶之间连上如图所示的装置,重新进行加热硝酸铜的实验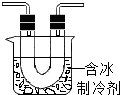 | 集气瓶中气体为无色,带火星木条复燃 | 硝酸铜分解生成了氧气 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
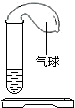 如图所示,开始在气球中装有某种固体,在试管中装有某种液体,实验之前,气球是瘪的.实验时,把气球中的固体倒入试管中,发现气球慢慢变大.请你预测该固体和液体药品.(提示:可以填物质的化学式,也可以填物质的名称)
如图所示,开始在气球中装有某种固体,在试管中装有某种液体,实验之前,气球是瘪的.实验时,把气球中的固体倒入试管中,发现气球慢慢变大.请你预测该固体和液体药品.(提示:可以填物质的化学式,也可以填物质的名称)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com