
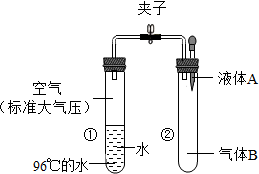
 如图所示,夹子开始处于关闭状态,将液体A滴入试管②与气体B充分发生化学反应;打开夹子,可发现试管①内的水立刻沸腾了.则液体A和气体B的组合最不可能是( )
如图所示,夹子开始处于关闭状态,将液体A滴入试管②与气体B充分发生化学反应;打开夹子,可发现试管①内的水立刻沸腾了.则液体A和气体B的组合最不可能是( )| A. | 稀硫酸、二氧化碳 | B. | 盐酸、氨气 | ||
| C. | 石灰水、氯化氢 | D. | 氢氧化钠溶液、二氧化硫 |
分析 水的沸点与压强有关,压强越小水的沸点越低.压强越大水的沸点越高.稀硫酸能吸收氨气,氢氧化钠溶液能吸收二氧化碳气体,打开夹子时①中的气体进入②中,从而使得①中的压强减小,水的沸点降低,水沸腾了.
解答 解:A、硫酸与二氧化碳不发生化学反应,装置内的压强不变,水不会沸腾,故符合题意;
B、稀盐酸能吸收氨气,打开夹子时①中的气体进入②中,从而使得①中的压强减小,水的沸点降低,水沸腾了.故不符合题意;
C、氢氧化钙能与氯化氢反应,打开夹子时①中的气体进入②中,从而使得①中的压强减小,水的沸点降低,水沸腾了.故不符合题意;
D、氢氧化钠溶液能吸收二氧化硫气体,打开夹子时①中的气体进入②中,从而使得①中的压强减小,水的沸点降低,水沸腾了.故不符合题意.
故选A.
点评 解答本题的关键是要充分理解水沸腾的原因,根据物质间反应后气体状态的改变,对问题做出正确的判断.


科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 洗衣机工作时,电能主要转化为机械能 | |
| B. | 汽车匀速下坡时,重力势能转化为动能 | |
| C. | 绿色植物的光合作用将光能转化为化学能 | |
| D. | 给电动车的电池充电,是将电能转化为化学能 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 铁丝在氧气中燃烧:银白色固体剧烈燃烧,火星四射,放出大量的热,生成黑色固体 | |
| B. | 高温条件下木炭还原氧化铜:黑色固体逐渐变成光亮的铜 | |
| C. | 电解水实验:两个电极附近产生气泡,一段时间后,正、负极产生的气体体积比约为2:1 | |
| D. | 铜片放人硝酸银溶液中:紫红色固体表面有银白色固体产生,溶液由蓝色逐渐变为无色 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 实验操作 | 实验现象 | 实验结论 | |
| 乙同学 实验 | 取中和反应后的溶液少许于试管中,将表面反复打磨后的铝片放入试管的溶液溶液中 | 铝片逐渐溶解, 收集气体点燃,火焰呈淡蓝色 | 猜想(2)成立 |
| 丙同学 实验 | 取中和反应后的溶液少许于试管中,向试管中滴加酚酞试液 | 溶液变色 | 猜想(3)成立 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 实验混合溶液 | 1 | 2 | 3 | 4 | 5 | 6 |
| 饱和硫酸铜溶液/mL | 0 | 0.5 | 2.5 | 5 | 10 | 20 |
| 水/mL | 20 | 19.5 | 17.5 | V | 10 | 0 |
| 实验1 | 实验2 | 实验3 | 实验4 | 实验5 | |
| 加入试剂0.5mL | 水 | 5%NaCl溶液 | 5%Mg(NO3)2溶液 | 5%FeSO4溶液 | 5%CuSO4溶液 |
| 产生气泡速率 | + | + | + | ++ | +++ |
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验步骤 | 现象和结论 | 有关反应的化学方程式 |
| 取少量滤纸上剩余的物质,加入适量的溶液 | 若产生气泡,则乙猜想正确,若不产生气泡,则甲猜想正确 | Fe+2HCl═FeCl2+H2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com