
分析 金属氧化物可以与酸反应生成盐和水,Cl2具有氧化性,能氧化Fe2+和铁生成氯化铁;氢氧化铁与稀盐酸反应,也可制取氯化铁.
解答 解:根据金属氧化物可以与酸反应生成盐和水,Cl2具有氧化性,能氧化Fe2+和铁生成氯化铁;氢氧化铁与稀盐酸反应,也可制取氯化铁,故可写出四种用铁及某化合物通过一步化学反应制取氯化铁的四个化学方程式:
①2Fe+3Cl2$\frac{\underline{\;高温\;}}{\;}$2FeCl3;
②Fe2O3+6HCl═2FeCl3+3H2O
③Fe(OH)3+3HCl═FeCl3+3H2O;
④2FeC12+3C12=2FeCl3
故答案为:①2Fe+3Cl2$\frac{\underline{\;高温\;}}{\;}$2FeCl3
②Fe2O3+6HCl═2FeCl3+3H2O
③Fe(OH)3+3HCl═FeCl3+3H2O
④2FeC12+3C12=2FeCl3.
点评 本题考查物质之间相互转化方面的知识,要掌握复分解反应发生的条件,并且学会具体的运用.


 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:选择题
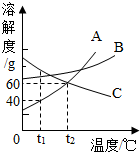 如图是A、B、C三种物质的溶解度曲线.下列说法不正确的是( )
如图是A、B、C三种物质的溶解度曲线.下列说法不正确的是( )| A. | t1℃时,100g水溶解了40gA就达到了饱和状态 | |
| B. | t2℃时,A和C的饱和溶液中溶质的质量分数相等 | |
| C. | t2℃时C的饱和溶液降温到t1℃时有晶体析出 | |
| D. | A和B的饱和溶液从t2℃降温到t1℃时,溶液的溶质质量分数都变小 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | NH4HCO3 | B. | Ca(H2PO4)2 | C. | K2CO3 | D. | CO(NH2)2 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | Na2O•CaO•6SiO2 | B. | 2Na2O•2CaO•9SiO2 | ||
| C. | 6Na2O•6CaO•SiO2 | D. | Na2O•CaO•3SiO2 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 苯甲酸钠由4种元素组成 | |
| B. | 食品添加剂影响人体健康,所以使用时要严格控制使用量 | |
| C. | 苯甲酸钠的相对分子质量为144 | |
| D. | 每个苯甲酸钠分子中含有一个氧分子 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com